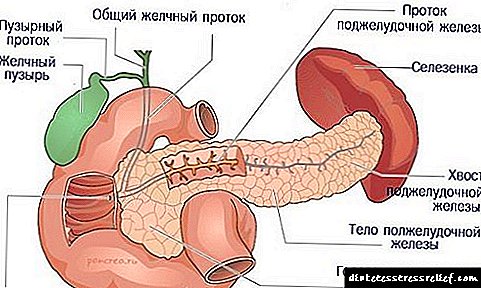
ជីវគីមីជីវគីមីកូលេស្តេរ៉ុលនិងជីវគីមីរបស់វា - ទឹកនោមផ្អែម
ដោយគ្មានការសង្ស័យកូលេស្តេរ៉ុលគឺជាខ្លាញ់ដែលត្រូវបានគេស្គាល់ច្រើនបំផុតសម្រាប់មនុស្សទូទៅវាមានកេរ្តិ៍ឈ្មោះដោយសារតែការជាប់ទាក់ទងគ្នាខ្ពស់រវាងកូលេស្តេរ៉ុលក្នុងឈាមខ្ពស់និងភាពញឹកញាប់នៃជំងឺសរសៃឈាមបេះដូងរបស់មនុស្ស។ ការយកចិត្តទុកដាក់តិចតួចត្រូវបានគេយកចិត្តទុកដាក់ចំពោះតួនាទីសំខាន់នៃកូលេស្តេរ៉ុលដែលជាសមាសធាតុនៃភ្នាសកោសិកានិងជាភ្នាក់ងារមុនសម្រាប់អរម៉ូនស្តេរ៉ូអ៊ីតនិងអាស៊ីតទឹកប្រមាត់។ កូលេស្តេរ៉ុលគឺចាំបាច់សម្រាប់សត្វជាច្រើនរួមទាំងមនុស្សផងដែរប៉ុន្តែវត្តមានរបស់វានៅក្នុងអាហារថនិកសត្វគឺស្រេចចិត្ត - កោសិការាងកាយពួកគេអាចសំយោគវាពីប្រភេទមុនធម្មតា។
រចនាសម្ព័ននៃសមាសធាតុកាបូន ២៧ នេះបង្ហាញថាជាមាគ៌ាស្មុគស្មាញសម្រាប់ជីវគីមីរបស់វាប៉ុន្តែអាតូមកាបោនទាំងអស់ត្រូវបានផ្តល់ដោយអាសេតានមុនគេ។ ប្លុកអ៊ីសូសូរិន - អន្តរការីសំខាន់បំផុតពីអាស៊ីតអាសេទិកទៅកូលេស្តេរ៉ុលពួកគេគឺជាអ្នកឈានមុខគេនៃជាតិខ្លាញ់ធម្មជាតិជាច្រើនហើយយន្តការដែលប្លុកអ៊ីសូតូនីញ៉ូមត្រូវបានបង្កើតឡើងមានលក្ខណៈប្រហាក់ប្រហែលគ្នានៅគ្រប់មេតាប៉ូលីស។
យើងចាប់ផ្តើមដោយពិចារណាលើដំណាក់កាលសំខាន់ៗក្នុងមាគ៌ានៃការធ្វើកោសល្យវិច័យកូឡេស្តេរ៉ុលពីអាសេតាតបន្ទាប់មកយើងពិភាក្សាពីការដឹកជញ្ជូនកូឡេស្តេរ៉ុលតាមរយៈចរន្តឈាមការស្រូបយករបស់វាដោយកោសិកាបទបញ្ញត្តិធម្មតានៃការសំយោគកូលេស្តេរ៉ុលនិងក្នុងករណីមានការថយចុះនៃការស្រូបយកឬដឹកជញ្ជូន។ បន្ទាប់មកយើងក្រឡេកមើលសារធាតុផ្សេងទៀតដែលមកពីកូលេស្តេរ៉ុលដូចជាអាស៊ីតទឹកប្រមាត់និងអរម៉ូនស្តេរ៉ូអ៊ីត។ ចុងបញ្ចប់ការពិពណ៌នាអំពីផ្លូវជីវសាស្រ្តសម្រាប់ការបង្កើតសមាសធាតុជាច្រើន - ដេរីវេនៃប្លុកអ៊ីសូតូរីនដែលក្នុងនោះមានដំណាក់កាលដំបូងជាទូទៅជាមួយនឹងការសំយោគកូឡេស្តេរ៉ុលបង្ហាញពីភាពអស្ចារ្យនៃវិសេសវិស័យសារជាតិខាប់នៅក្នុងអ៊ីសូហ្សែន។
កូឡេស្តេរ៉ុលត្រូវបានផលិតចេញពីអាសេទីល - កូអាជាបួនដំណាក់កាល
កូលេស្តេរ៉ុលដូចជាអាស៊ីតខ្លាញ់សង្វាក់វែងត្រូវបានផលិតចេញពីអាសេទីល - កូអាប៉ុន្តែលំនាំការជួបប្រជុំគ្នាគឺខុសគ្នាទាំងស្រុង។ នៅក្នុងការពិសោធន៍ដំបូងអាសេតាទីនមានផ្លាកលេខ ១៤ អង្សាសេទាំងអាតូមកាបូនមេទីលឬខាណូលីត្រូវបានបញ្ចូលទៅក្នុងចំណីសត្វ។ ផ្អែកលើការចែកចាយស្លាកនៅក្នុងកូលេស្តេរ៉ុលដែលដាច់ឆ្ងាយពីសត្វពីរក្រុម (រូបភាព ២១-៣២) ដំណាក់កាលអង់ស៊ីមនៃជីវគីមីកូឡេស្តេរ៉ុលត្រូវបានពិពណ៌នា។
រូបភព។ ២១-៣២ ។ ប្រភពនៃអាតូមកាបូននៃកូលេស្តេរ៉ុល។ បានកំណត់អត្តសញ្ញាណក្នុងកំឡុងពេលពិសោធន៍ដោយប្រើអាសេតានវិទ្យុសកម្មដែលមានស្លាកកាបូនមេតាណុល (ខ្មៅ) ឬកាបូនកាបូអ៊ីដ (ក្រហម) ។ នៅក្នុងរចនាសម្ព័ន្ធខាប់ចិញ្ចៀនត្រូវបានតាងដោយអក្សរ A ដល់ឃ។

ការសំយោគកើតឡើងជាបួនដំណាក់កាលដូចបង្ហាញក្នុងរូប។ ២១-៣៣: (១) ការរួមផ្សំនៃសំណល់អាសេតាល់ចំនួន ៣ ជាមួយនឹងការបង្កើតសារធាតុកាបូអ៊ីដ្រាតកម្រិត ៦ កាបូអ៊ីដ្រាត (២) ការបំលែងនៃមេតាសេតាតទៅជាប្លុកអ៊ីស្ត្រូសសកម្ម (៣) ការធ្វើវត្ថុធាតុ polymerization នៃអ៊ីសូតូរីនកាបូនចំនួន ៦ គ្រឿងជាមួយនឹងការបង្កើតកាឡាញេលីនលីនកាបោនចំនួន ៣០ កាបូអ៊ីដ (៤) វដ្តស៊ីលីនសេនទៅជាទម្រង់។ រង្វង់បួននៃស្នូលស្តេរ៉ូអ៊ីតបន្ទាប់មកមានការផ្លាស់ប្តូរជាបន្តបន្ទាប់ (កត់សុីការដកយកចេញឬការធ្វើចំណាកស្រុករបស់ក្រុមមេទីល) ជាមួយនឹងការបង្កើតកូលេស្តេរ៉ុល។
រូបភព។ ២១-៣៣ ។ រូបភាពទូទៅនៃជីវគីមីជីវសាស្ត្រកូលេស្តេរ៉ុល។ ការសំយោគបួនដំណាក់កាលត្រូវបានពិភាក្សានៅក្នុងអត្ថបទ។ ប្លុកអ៊ីសូរិននៅក្នុង squalene ត្រូវបានសម្គាល់ដោយបន្ទាត់ដាច់ ៗ ពណ៌ក្រហម។

ដំណាក់កាល (១) ។ សំយោគនៃ mevalonate ពីអាសេតាន។ ដំណាក់កាលទី ១ នៃការធ្វើកោសល្យវិច័យជីវសាស្ត្រកូលេស្តេរ៉ុលនាំទៅរកការបង្កើតផលិតផលកម្រិតមធ្យម mevalonate (រូបភាព ២១-៣៤) ។ ម៉ូលេគុលអាសេទីលកូអាចំនួនពីរធ្វើឱ្យអាសេតាកាកាឡីកូអាដែលខាប់ជាមួយម៉ូលេគុលអាសេទីលកូអាទី ៣ បង្កើតជាសមាសធាតុកាបូន ៦ ។ β-hydroxy-β-methylglutaryl-CoA (HM G -CoA) ។ ប្រតិកម្មដំបូងទាំងពីរនេះគឺមានសារធាតុ thiolase និង NM G -CoA synthase រៀងៗខ្លួន។ កូតូកូល NM G-CoA សំយោគ ផ្លូវមេតាប៉ូលីសនេះខុសគ្នាពីអ៊ីតូហ្សូណូអ៊ីសូហ្សីមេនដែលជំរុញការសំយោគរបស់អិមអិមជី -CoA ក្នុងកំឡុងពេលបង្កើតសាកសពកេតone (សូមមើលរូបភាព ១៧-១៨) ។
រូបភព។ ២១-៣៤ ។ ការបង្កើត mevalonate ពីអាសេទីល - កូ។ ប្រភពនៃ C-1 និង C-2 mevalonate ពីអាសេទីល - កូអាត្រូវបានបន្លិចជាពណ៌ផ្កាឈូក។

ប្រតិកម្មទីបីកំណត់ល្បឿននៃដំណើរការទាំងមូល។ នៅក្នុងវា NM G -CoA ត្រូវបានកាត់បន្ថយទៅ mevalonate ដែលម៉ូលេគុលNА D PH នីមួយៗផ្តល់អេឡិចត្រុងពីរ។ HMG-CoA reductase - ប្រូតេអ៊ីនភ្នាសអាំងតេក្រាលនៃអេសអិលរលោងវាបម្រើដូចដែលយើងនឹងឃើញនៅពេលក្រោយដែលជាចំណុចសំខាន់នៃបទប្បញ្ញត្តិនៃផ្លូវរំលាយអាហារនៃការបង្កើតកូលេស្តេរ៉ុល។
ដំណាក់កាល (២) ។ ការផ្លាស់ប្តូរនៃ mevalonate ទៅជា isoprene សកម្មពីរ។ នៅដំណាក់កាលបន្ទាប់នៃការសំយោគកូលេស្តេរ៉ុលក្រុមផូស្វាសចំនួនបីត្រូវបានផ្ទេរពីម៉ូលេគុលអេធីភីទៅម៉ាវ៉េថេត (រូបភាព ២១-៣៥) ។ ផូស្វាតបានចងភ្ជាប់ទៅនឹងក្រុមអ៊ីដ្រូហ្សូលីនៅ C-3 mevalonate ក្នុងកំរិតមធ្យម ៣-phospho-5-pyrophosphomevalonate ជាក្រុមចាកចេញល្អមួយនៅជំហានបន្ទាប់ទាំងពីរនៃផូទាំងនេះនិងក្រុមខារ៉ូលនៅជិតបន្សល់ទុកបង្កើតជាចំណងទ្វេនៅក្នុងផលិតផលកាបូន ៥ ∆ ៣ -isopentenyl pyrophosphate ។ នេះគឺជាអ៊ីសូហ្វីនដំបូងបង្អស់ក្នុងចំណោមពីរដែលត្រូវបានធ្វើឱ្យសកម្ម - អ្នកចូលរួមសំខាន់ក្នុងការសំយោគកូលេស្តេរ៉ុល។ Isomerization នៃΔ 3 -isopentenylpyrophosphate ផ្តល់ឱ្យ isoprene ធ្វើឱ្យសកម្មលើកទីពីរ dimethylallyl pyrophosphate ។ ការសំយោគ isopentenyl pyrophosphate នៅក្នុង cytoplasm នៃកោសិការុក្ខជាតិកើតឡើងស្របតាមផ្លូវដែលបានពិពណ៌នានៅទីនេះ។ ទោះជាយ៉ាងណាក៏ដោយរុក្ខជាតិក្លូរីនស្យូមនិងបាក់តេរីជាច្រើនប្រើផ្លូវឯករាជ្យនៃមេតាសេតា។ ផ្លូវជំនួសនេះមិនត្រូវបានរកឃើញនៅក្នុងសត្វទេដូច្នេះវាមានភាពទាក់ទាញនៅពេលបង្កើតថ្នាំអង់ទីប៊ីយោទិចថ្មី។
រូបភព។ ២១-៣៥ ។ ការផ្លាស់ប្តូរនៃ mevalonate ទៅជាប្លុក isoprene ដែលបានធ្វើឱ្យសកម្ម។ គ្រឿងដែលបានធ្វើឱ្យសកម្មទាំងប្រាំមួយបញ្ចូលគ្នាបង្កើតជា squalene (សូមមើលរូបភាព ២១-៣៦) ។ ក្រុមចាកចេញនៃ 3-phospho-5-pyrophosphomevalonate ត្រូវបានបន្លិចជាពណ៌ផ្កាឈូក។ នៅក្នុងតង្កៀបការ៉េគឺជាមធ្យមសម្មតិកម្ម។

ដំណាក់កាល (៣) ។ ការធ្វើឱ្យធូររលុងនៃគ្រឿងអ៊ីសូតូមចំនួន ៦ ដែលត្រូវបានធ្វើឱ្យសកម្មបង្កើតបានជាសារធាតុ squalene ។ អ៊ីត្រូផិនលីយ pyrophosphate និងឌីមីតលីលីលេក្យូផូសផូសផូសផូសផូសផូសផូផូផូផូផូផូផូលីមនៅពេលនេះត្រូវបានដាក់ជាកំណកក្បាលទៅកន្ទុយដែលក្នុងនោះក្រុមផូរ៉ូផូស្វូមួយផ្លាស់ទីនិងបង្កើតជាខ្សែសង្វាក់កាបូន ១០ ។ - geranyl pyrophosphate (រូបភាព ២១-៣៦) ។ (Pyrophosphate ភ្ជាប់ទៅនឹងក្បាល។ ) Geranyl pyrophosphate ឆ្លងកាត់ការរួមបញ្ចូលគ្នានៃក្បាលទៅកន្ទុយជាមួយនឹងអ៊ីសូទីននីយ pyrophosphate និងមានទំរង់កណ្ដាលកាបូន ១៥ ។ farnesyl pyrophosphate ។ នៅទីបំផុតម៉ូលេគុលពីរនៃអេរ៉ូអ៊ីល pyrophosphate ផ្សំ“ ពីក្បាលទៅមួយ” ក្រុមផូស្វ័រទាំងពីរត្រូវបានយកចេញ - បង្កើត squalene ។
រូបភព។ ២១-៣៦ ។ ការបង្កើត Squalene ។ រចនាសម្ព័ន squalene ដែលមានអាតូមកាបូនចំនួន ៣០ កើតឡើងក្នុងកំឡុងពេលខាប់ជាប់ៗគ្នាដែលត្រូវបានធ្វើឱ្យសកម្មដោយប្លុកអ៊ីសូរិន (កាបោន ៥) ។

ឈ្មោះទូទៅសម្រាប់អន្តរការីទាំងនេះមកពីឈ្មោះប្រភពដែលពួកគេត្រូវបានគេញែកដាច់ពីគ្នាដំបូង។ ជីរីណុលដែលជាសមាសធាតុនៃប្រេងបានកើនឡើងមានរសជាតិ geranium និង farnesol ដែលត្រូវបានគេរកឃើញនៅក្នុងពណ៌នៃអាកាស្យាណាណាមានផ្កាលីលីនៃជ្រលងភ្នំ។ ក្លិនរុក្ខជាតិធម្មជាតិជាច្រើនជារបស់សមាសធាតុផ្សំឡើងពីប្លុកអ៊ីសូឡង់។ Squalene ដំបូងដាច់ឆ្ងាយពីថ្លើមត្រីឆ្លាម (ប្រភេទ Squalus) មានអាតូមកាបូនចំនួន ៣០: អាតូម ២៤ នៅក្នុងសង្វាក់សំខាន់និងអាតូម ៦ នៅក្នុងធាតុជំនួសដែក។
ដំណាក់កាល (៤) ។ ការផ្លាស់ប្តូរ squalene ទៅជារង្វង់បួននៃស្នូលស្តេរ៉ូអ៊ីត។ ក្នុងរូបភព។ 21-37 វាត្រូវបានគេមើលឃើញយ៉ាងច្បាស់ថារចនាសម្ព័ន្ធខ្សែសង្វាក់ squalene និង sterols - ស៊ីក្លូ។ sterols ទាំងអស់មានចិញ្ចៀនអាពាហ៍ពិពាហ៍ដែលមានជាតិខាប់ចំនួន ៤ ដែលបង្កើតជាស្នូលស្តេរ៉ូអ៊ីតហើយពួកវាទាំងអស់សុទ្ធតែមានជាតិអាល់កុលជាមួយក្រុមអ៊ីដ្រូហ្សីនៅអេកអឹម ៣ ហេតុដូចនេះហើយបានជាឈ្មោះអង់គ្លេសហៅថាស្តេរ៉ូអ៊ីត។ កំពុងធ្វើសកម្មភាព squalene monooxygenase អាតូមអុកស៊ីសែនមួយពីអូត្រូវបានបន្ថែមទៅខាងចុងខ្សែសង្វាក់ផ្កាភ្លើង 2 និង epoxide មួយត្រូវបានបង្កើតឡើង។ អង់ស៊ីមនេះគឺជាអុកស៊ីដកម្មដែលមានមុខងារចម្រុះ (បន្ថែម ២១-១) NADPH កាត់បន្ថយអាតូមអុកស៊ីសែនមួយទៀតពីអូ។ 2 ទៅក្រុមហ៊ុន H2 អូ។ ចំណងទ្វេរដងផលិតផល squalene-2,3-epoxide រៀបចំដូច្នេះថាប្រតិកម្មដែលគួរឱ្យកត់សម្គាល់គួរឱ្យកត់សម្គាល់អាចប្រែក្លាយខ្សែសង្វាក់អេល៉ូហ្សែលទៅជារចនាសម្ព័ន្ធរង្វិល។ នៅក្នុងកោសិកាសត្វវដ្តនេះនាំឱ្យមានការបង្កើត lanosterol ដែលមានចិញ្ចៀនអាពាហ៍ពិពាហ៍បួនលក្ខណៈនៃស្នូលស្តេរ៉ូអ៊ីត។ ជាលទ្ធផលថ្នាំ lanosterol ត្រូវបានបំលែងទៅជាកូលេស្តេរ៉ុលតាមរយៈស៊េរីនៃប្រតិកម្មប្រមាណ ២០ ដែលរួមមានការធ្វើចំណាកស្រុករបស់ក្រុមដែកមួយចំនួននិងការដកយកចេញនូវសារធាតុផ្សេងៗទៀត។ ការពិពណ៌នាអំពីផ្លូវជីវសាស្ត្រដ៏អស្ចារ្យនេះដែលជាការលំបាកមួយក្នុងចំណោមការស្គាល់ដែលត្រូវបានបង្កើតឡើងដោយ Conrad Bloch, Theodore Linen, John Cornfort និង George Popiak នៅចុងទសវត្ស ១៩៥០ ។
រូបភព។ ២១-៣៧ ។ ការបិទក្រវ៉ាត់ប្រែទៅជា squalene លីនេអ៊ែរទៅជាស្នូលស្តេរ៉ូអ៊ីដ។ ដំណាក់កាលទីមួយត្រូវបានបង្កើតឡើងដោយអុកស៊ីតកម្មដែលមានមុខងារចម្រុះ (monooxygenase) ដែលកូស៊ីនុសរបស់វាគឺអេឌីអេអេភី។ ផលិតផលនេះគឺជាអេសូស៊ីដដែលនៅដំណាក់កាលបន្ទាប់វដ្ដបង្កើតជាស្នូលស្តេរ៉ូអ៊ីត។ ផលិតផលចុងក្រោយនៃប្រតិកម្មទាំងនេះនៅក្នុងកោសិកាសត្វគឺកូលេស្តេរ៉ុលហើយនៅក្នុងសារពាង្គកាយដទៃទៀតស្តេរ៉ូអ៊ីតខុសគ្នាបន្តិចបន្តួចពីវាត្រូវបានបង្កើតឡើង។


កូលេស្តេរ៉ុលគឺជាចរិតស្តេរ៉ូអ៊ីតរបស់កោសិកាសត្វរុក្ខជាតិផ្សិតនិងប្រូតេស្តង់ផលិតនូវអេស្ត្រូសែនស្រដៀងគ្នាផ្សេងទៀត។
ពួកគេប្រើផ្លូវសំយោគដូចគ្នាទៅនឹងថ្នាំ squalene-2,3-epoxide ប៉ុន្តែបន្ទាប់មកផ្លូវទាំងនោះមានភាពខុសគ្នាបន្តិចហើយសារធាតុស្តេរ៉ូអ៊ីតផ្សេងទៀតត្រូវបានបង្កើតឡើងដូចជា sigmasterol នៅក្នុងរុក្ខជាតិជាច្រើននិង ergosterol នៅក្នុងផ្សិត (រូបភាពទី ២១-៣៧) ។
ឧទាហរណ៍ ២១-១ ការចំណាយថាមពលសម្រាប់សំយោគ Squalene
តើការចំណាយថាមពល (ត្រូវបានបង្ហាញជាម៉ូលេគុលអេអេធីភី) សម្រាប់ការសំយោគម៉ូលេគុល squalene មួយ?
ដំណោះស្រាយ។ នៅក្នុងការសំយោគ squalene ពីអាសេទីល -CoA ATP ត្រូវបានចំណាយតែនៅដំណាក់កាលនៅពេលដែល mevalonate ត្រូវបានបំលែងទៅជាភ្នាក់ងារ squalene មុនដែលមានសកម្មភាព។ ម៉ូលេគុល isoprene ចំនួន ៦ ដែលសកម្មត្រូវបានគេត្រូវការដើម្បីបង្កើតម៉ូលេគុល squalene ហើយម៉ូលេគុល ATP ចំនួន ៣ ត្រូវបានគេ តម្រូវឲ្យ ផលិតម៉ូលេគុលដែលបានធ្វើឱ្យសកម្មនីមួយៗ។ ជាសរុបម៉ូលេគុលអេធីភីចំនួន ១៨ ត្រូវបានចំណាយទៅលើការសំយោគម៉ូលេគុល squalene មួយ។
សមាសធាតុនៃកូលេស្តេរ៉ុលនៅក្នុងខ្លួន
នៅក្នុងឆ្អឹងកងខ្នងបរិមាណកូលេស្តេរ៉ុលច្រើនត្រូវបានសំយោគនៅក្នុងថ្លើម។ កូលេស្តេរ៉ុលមួយចំនួនត្រូវបានសំយោគនៅទីនោះត្រូវបានដាក់បញ្ចូលទៅក្នុងភ្នាសរបស់ hepatocytes ប៉ុន្តែវាត្រូវបាននាំចេញជាទម្រង់មួយក្នុងចំណោមទំរង់បីរបស់វាគឺកូលេស្តេរ៉ុល (ទឹកប្រមាត់) អាស៊ីតទឹកប្រមាត់ឬអាស៊ីតកូលេស្តេរ៉ុល។ អាស៊ីតទឹកប្រមាត់ ហើយអំបិលរបស់វាគឺជានិស្សន្ទវត្ថុនៃកូលេស្តេរ៉ុលដែលត្រូវបានសំយោគនៅក្នុងថ្លើមនិងរួមចំណែកដល់ការរំលាយអាហារជាតិខ្លាញ់ (សូមមើលរូបភាព ១៧-១) ។ កូលេស្តេរ៉ុល បង្កើតឡើងនៅក្នុងថ្លើមដោយសកម្មភាព acyl-CoA-cholesterol-acyltransferase (ACAT) ។ អង់ស៊ីមនេះជួយជំរុញការផ្ទេរសំណល់អាស៊ីតខ្លាញ់ពី coenzyme A ទៅក្រុមអ៊ីដ្រូហ្សីលីនៃកូលេស្តេរ៉ុល (រូបភាព ២១-៣៨) ដោយប្រែកូលេស្តេរ៉ុលទៅជាទម្រង់ hydrophobic ។ កូលេស្តេរ៉ុលអេស្ត្រូសែននៅក្នុងភាគល្អិត lipoprotein សម្ងាត់ត្រូវបានបញ្ជូនទៅជាលិកាផ្សេងទៀតដោយប្រើកូលេស្តេរ៉ុលឬផ្ទុកនៅក្នុងថ្លើម។
រូបភព។ ២១-៣៨ ។ សំយោគកូលេស្តេរ៉ុល។ Etherification ធ្វើឱ្យកូលេស្តេរ៉ុលក្លាយជាទម្រង់ hydrophobic កាន់តែច្រើនសម្រាប់ផ្ទុកនិងដឹកជញ្ជូន។

កូលេស្តេរ៉ុលគឺចាំបាច់សម្រាប់គ្រប់ជាលិកាទាំងអស់នៃសារពាង្គកាយសត្វដែលកំពុងលូតលាស់សម្រាប់ការសំយោគភ្នាសហើយសរីរាង្គខ្លះ (ឧទាហរណ៍ក្រពេញក្រពេញនិងក្រពេញភេទ) ប្រើកូលេស្តេរ៉ុលដែលជាកត្តាមុននៃអរម៉ូនស្តេរ៉ូអ៊ីត (នេះនឹងត្រូវបានពិភាក្សាខាងក្រោម) ។ កូលេស្តេរ៉ុលក៏ជាកត្តាឈានមុខគេដែរចំពោះវីតាមីនឌី (សូមមើលរូបភាពទី ១០-២០ ទំព័រ ១) ។
កូលេស្តេរ៉ុលនិងជាតិខ្លាញ់ដទៃទៀតមានផ្ទុក lipoproteins ប្លាស្មា
កូលេស្តេរ៉ុលនិងកូលេស្តេរ៉ុលដូចជា triacylglycerols និង phospholipids គឺមិនអាចរំលាយបានក្នុងទឹកទោះយ៉ាងណាពួកគេត្រូវផ្លាស់ប្តូរពីជាលិកាដែលវាត្រូវបានគេសំយោគទៅជាលិកាដែលវានឹងត្រូវរក្សាទុករឺប្រើប្រាស់។ ពួកវាត្រូវបានដឹកដោយចរន្តឈាមតាមទំរង់ lipoproteins ប្លាស្មា - ស្មុគស្មាញ macromolecular នៃប្រូតេអ៊ីនក្រុមហ៊ុនដឹកជញ្ជូនជាក់លាក់ (apolipoproteins) ជាមួយផូស្វ័រកូឡេស្តេរ៉ុលកូលេស្តេរ៉ូលកូលេស្តេរ៉ុលនិងសារធាតុ triacylglycerols មាននៅក្នុងស្មុគស្មាញទាំងនេះក្នុងបន្សំផ្សេងៗគ្នា។
អាប៉ូប៉ូប៉ូត្រូត្រាទីន (អាប៉ូប៉ូសំដៅទៅលើប្រូតេអ៊ីនគ្មានជាតិខ្លាញ់ដោយខ្លួនវា) ផ្សំជាមួយជាតិខ្លាញ់ដើម្បីបង្កើតជាភាគតូចៗនៃភាគល្អិត lipoprotein - ស្មុគស្មាញស្វ៊ែរជាមួយ lipid hydrophobic នៅកណ្តាលនិងច្រវ៉ាក់អាស៊ីដអាមីណូហ្វីហ្វីលីកនៅលើផ្ទៃ (រូបភាព ២១-៣៩, ក) ។ ជាមួយនឹងការរួមផ្សំផ្សេងៗគ្នានៃជាតិខ្លាញ់និងប្រូតេអ៊ីនភាគល្អិតនៃដង់ស៊ីតេផ្សេងៗគ្នាត្រូវបានបង្កើតឡើង - ពី chylomicrons រហូតដល់ lipoproteins ដង់ស៊ីតេខ្ពស់។ ភាគល្អិតទាំងនេះអាចត្រូវបានបំបែកចេញពីគ្នាដោយការបំបែករូបភាព (តារាង ២១-១) និងមើលឃើញដោយប្រើមីក្រូទស្សន៍អេឡិចត្រុង (រូបភាព ២១-៣៩, ខ) ។ ប្រភាគនីមួយៗនៃថ្នាំ lipoproteins អនុវត្តមុខងារជាក់លាក់មួយដែលត្រូវបានកំណត់ដោយកន្លែងសំយោគសមាសធាតុខ្លាញ់និងមាតិកាអាប៉ូប៉ូហ្វីប៉ូទីន។ យ៉ាងហោចណាស់មានថ្នាំអាប៉ូប៉ូភីត្រូទីនផ្សេងៗគ្នាចំនួន ១០ ត្រូវបានគេរកឃើញនៅក្នុងប្លាស្មាឈាមរបស់មនុស្ស (តារាង ២១-២) ដែលមានទំហំខុសៗគ្នាមានប្រតិកម្មជាមួយនឹងអង្គបដិប្រាណជាក់លាក់និងការបែងចែកលក្ខណៈនៅក្នុងវណ្ណៈ lipoproteins ផ្សេងៗគ្នា។ សមាសធាតុប្រូតេអ៊ីនទាំងនេះដើរតួជាសារធាតុដែលផ្តល់សញ្ញាដឹកនាំ lipoproteins ទៅកាន់ជាលិកាជាក់លាក់ឬអង់ស៊ីមដែលធ្វើសកម្មភាពលើ lipoproteins ។
តារាង ២១-១ ។ lipoproteins ប្លាស្មារបស់មនុស្ស
សមាសភាព (ប្រភាគជាភាគរយ)
r = 513,000) ។ ភាគល្អិតអិល។ អិល។ អិលមួយមានស្នូលកូលេស្តេរ៉ុលកូលេស្តេរ៉ុលប្រមាណ ១៥០០ ម៉ូលេគុលនៅជុំវិញស្នូលមានសែលកូឡេស្តេរ៉ូល ៥០០ ម៉ូលេគុលផូស្វ័រហ្វីលីព ៨០០ និងម៉ូលេគុលអាប៉ូប៊ី ១០០ ។ ខ - lipoproteins បួនប្រភេទដែលអាចមើលឃើញដោយមីក្រូទស្សន៍អេឡិចត្រុង (បន្ទាប់ពីការបង្ហាញអវិជ្ជមាន) ។ តាមទ្រនិចនាឡិកាដោយចាប់ផ្តើមពីរូបខាងឆ្វេងផ្នែកខាងលើ៖ chylomicrons - មានអង្កត់ផ្ចិតពី ៥០ ទៅ ២០០ nm, PL O NP - ពី ២៨ ដល់ ៧០ nm, HDL - ពី ៨ ដល់ ១១ nm និងអិលអិលអិល - ពី ២០ ទៅ ៥៥ nm ។ លក្ខណៈសម្បត្តិរបស់ lipoproteins ត្រូវបានផ្តល់ឱ្យក្នុងតារាង។ ២១-២ ។

Chylomicrons, យោងទៅក្នុងវិ។ 17, ផ្លាស់ទី triacylglycerols អាហារពីពោះវៀនទៅជាលិកាផ្សេងទៀត។ ទាំងនេះគឺជាសារធាតុ lipoproteins ធំបំផុតពួកគេមានដង់ស៊ីតេទាបបំផុតនិងមាតិកាដែលទាក់ទងខ្ពស់បំផុតនៃសារធាតុទ្រីយ៉ាទីឡឺសឺរ (សូមមើលរូបភាពទី ១៧-២) ។ Chylomicrons ត្រូវបានគេសំយោគនៅក្នុងអេ។ អិលនៃកោសិការ epithelial តម្រង់ជួរពោះវៀនតូចបន្ទាប់មកផ្លាស់ទីតាមរយៈប្រព័ន្ធឡាំហ្វាទិចនិងចូលទៅក្នុងចរន្តឈាមតាមរយៈសរសៃ subclavian ខាងឆ្វេង។ ថ្នាំ Chylomicron apolipoproteins មានផ្ទុក apoB-48 (មានលក្ខណៈពិសេសសម្រាប់ប្រភេទ lipoproteins នេះ), apoE និង apoC-II (តារាង ២១-២) ។ AroC-II ធ្វើឱ្យ lipase lipoprotein ធ្វើឱ្យសកម្មនៅក្នុងជាលិការនៃជាលិកា adipose, បេះដូង, សាច់ដុំគ្រោងឆ្អឹងនិងក្រពេញទឹកដោះម្តាយដែលបំបៅដោយផ្តល់អាស៊ីតខ្លាញ់សេរីដល់ជាលិកាទាំងនេះ។ ដូច្នេះ chylomicrons ផ្ទេរអាស៊ីតខ្លាញ់អាហារទៅជាលិកាដែលជាកន្លែងដែលពួកគេនឹងត្រូវបានគេប្រើប្រាស់ឬរក្សាទុកជាឥន្ធនៈ (រូបភាព ២១-៤០) ។ សំណល់ Chylomicron (ភាគច្រើនត្រូវបានដោះលែងពីថ្នាំ triacylglycerols ប៉ុន្តែនៅតែផ្ទុកកូលេស្តេរ៉ុល apoE និង apoB-48) ត្រូវបានដឹកដោយចរន្តឈាមទៅថ្លើម។ នៅក្នុងថ្លើមអ្នកទទួលភ្ជាប់ទៅនឹង apoE ដែលមាននៅក្នុងសំណល់ chylomicron និងសម្របសម្រួលការស្រូបយករបស់ពួកគេដោយជំងឺ endocytosis ។ នៅក្នុង hepatocytes, សំណល់ទាំងនេះបញ្ចេញកូលេស្តេរ៉ុលដែលពួកគេមានហើយត្រូវបានបំផ្លាញនៅក្នុងលីស្យូម។
តារាង ២១-២ ។ lipoprotein ប្លាស្មារបស់មនុស្ស
មុខងារ (បើដឹង)
ធ្វើឱ្យសកម្ម L CAT ធ្វើអន្តរកម្មជាមួយអ្នកបញ្ជូនអេបផល
ហាមឃាត់ L CAT
ធ្វើឱ្យសកម្ម L CAT ការដឹកជញ្ជូន / ការបោសសំអាតកូឡេស្តេរ៉ុល
ភ្ជាប់ទៅនឹងអ្នកទទួលអិល។ អិល
Chylomicrons, VLDL, HDL
Chylomicrons, VLDL, HDL
Chylomicrons, VLDL, HDL
ចាប់ផ្តើមបោសសំអាតសំណល់ VLDL និង chylomicron
នៅពេលអាហារមានអាស៊ីតខ្លាញ់ច្រើនជាងវាបច្ចុប្បន្នអាចត្រូវបានប្រើជាឥន្ធនៈពួកគេប្រែទៅជា triacylglycerols នៅក្នុងថ្លើមដែលបង្កើតជាប្រភាគជាមួយ apolipoproteins ជាក់លាក់។ lipoproteins ដង់ស៊ីតេទាប (VLDL) ។ កាបូអ៊ីដ្រាតច្រើនពេកនៅក្នុងថ្លើមក៏អាចត្រូវបានបំប្លែងទៅជាសារធាតុទ្រីយ៉ាល់ឡឺសឺរូសនិងនាំចេញជាវ៉ាយអិលអិល (រូបភាព ២១-៤០, ក) ។បន្ថែមលើសារធាតុទ្រីយ៉ាស៊ីឡឺសឺឡែតប្រភាគ VLDL មានបរិមាណកូលេស្តេរ៉ុលនិងកូលេស្តេរ៉ុលក៏ដូចជាអេដូប៊ីប៊ី -១០ អាប៉ូស៊ី ១ អ៊ីប៉ូអេសទី ៣ និងអេដូអ៊ី (តារាង ២១-២) ។ lipoproteins ទាំងនេះក៏ត្រូវបានដឹកជញ្ជូនដោយឈាមពីថ្លើមទៅសាច់ដុំនិងជាលិកា adipose ដែលជាកន្លែងបន្ទាប់ពី lipoprotein lipase ត្រូវបានធ្វើឱ្យសកម្មដោយ apo-C II អាស៊ីតខ្លាញ់សេរីត្រូវបានដោះលែងពីសារធាតុទ្រីយ៉ាស៊ីឡឺសឺរនៃប្រភាគ VLDL ។ Adipocytes ចាប់យកអាស៊ីតខ្លាញ់ឥតគិតថ្លៃជាថ្មីម្តងទៀតបង្វែរវាទៅជាសារធាតុទ្រីយ៉ាស៊ីលីសស្តេរ៉ូលដែលត្រូវបានរក្សាទុកនៅក្នុងកោសិកាទាំងនេះក្នុងទម្រង់ជាការដាក់បញ្ចូលជាតិខ្លាញ់ (ដំណក់) myocytes ផ្ទុយទៅវិញបង្កើតអុកស៊ីតកម្មអាស៊ីតខ្លាញ់ភ្លាមៗដើម្បីបង្កើតថាមពល។ សំណល់ VLDL ភាគច្រើនត្រូវបានលុបចេញពីចរន្តឈាមដោយ hepatocytes ។ ការស្រូបយករបស់ពួកគេស្រដៀងនឹងការស្រូបយកសារធាតុ chylomicron ត្រូវបានសម្របសម្រួលដោយអ្នកទទួលនិងអាស្រ័យលើវត្តមានរបស់ apoE នៅក្នុងសំណល់ VLDL (បន្ថែម ២១-២ ទំនាក់ទំនងរវាងអាប៉ូអ៊ីនិងជម្ងឺវង្វេងត្រូវបានពិពណ៌នា) ។
រូបភព។ ២១-៤០ ។ Lipoproteins និង lipid ដឹកជញ្ជូននិង - lipids ត្រូវបានដឹកដោយចរន្តឈាមតាមទំរង់ lipoproteins ដែលត្រូវបានផ្សំជាប្រភាគជាច្រើនជាមួយមុខងារផ្សេងគ្នានិងសមាសធាតុខុសគ្នានៃប្រូតេអ៊ីននិង lipid (តារាង ២១-១ ២១-២) និងត្រូវគ្នាទៅនឹងដង់ស៊ីតេនៃប្រភាគទាំងនេះ។ ខ្លាញ់ក្នុងអាហារត្រូវបានគេប្រមូលផ្តុំទៅជាសារធាតុ Chylomicron ដែលភាគច្រើននៃសារធាតុទ្រីយ៉ាល់ឡឺសឺរដែលមាននៅក្នុងនោះត្រូវបានបញ្ចេញដោយ lipoprotein lipase ចូលទៅក្នុងជាលិកា adipose និងសាច់ដុំនៅក្នុងសរសៃឈាមតូចៗ។ សំណល់ Chylomicron (ផ្ទុកប្រូតេអ៊ីននិងកូឡេស្តេរ៉ុលជាចម្បង) ត្រូវបានចាប់យកដោយ hepatocytes ។ ជាតិខ្លាញ់ក្នុងឈាមនិងកូលេស្តេរ៉ុលពីថ្លើមត្រូវបានបញ្ជូនទៅជាលិកា adipose និងសាច់ដុំក្នុងទម្រង់ជា VLDL ។ ការបញ្ចេញជាតិ lipids ពី VLDL (រួមជាមួយការបាត់បង់អាប៉ូប៉ូហ្វីតូទីនមួយចំនួន) បំលែងជាបណ្តើរ ៗ នូវ VLDLP ទៅជាអិល។ អិល។ អេ។ ដែលផ្តល់កូលេស្តេរ៉ុលទៅជាលិការខាងក្រៅឬបញ្ជូនវាទៅថ្លើមវិញ។ ថ្លើមចាប់យកសំណល់នៃ VLDL, អិល។ អិល។ អិល។ និងសំណល់នៃសារធាតុ Chylomicron ដោយការទទួល - អរម៉ូន endocytosis ។ កូលេស្តេរ៉ុលដែលលើសនៅក្នុងជាលិកាពិសេសត្រូវបានដឹកត្រឡប់ទៅថ្លើមតាមទំរង់អិល។ អិល។ អិល .។ នៅក្នុងថ្លើមផ្នែកមួយនៃកូលេស្តេរ៉ុលប្រែទៅជាអំបិលទឹកប្រមាត់។ ខ - គំរូប្លាស្មាឈាមដែលត្រូវបានយកបន្ទាប់ពីអត់អាហារ (ខាងឆ្វេង) និងបន្ទាប់ពីញ៉ាំអាហារដែលមានជាតិខ្លាញ់ខ្ពស់ (ខាងស្តាំ) ។ សារធាតុ Chylomicrons ដែលបង្កើតឡើងដោយការបរិភោគអាហារដែលមានជាតិខ្លាញ់ផ្តល់ឱ្យប្លាស្មាមានលក្ខណៈស្រដៀងទៅនឹងទឹកដោះគោ។

ជាមួយនឹងការបាត់បង់សារធាតុទ្រីយ៉ាស៊ីឡឺស្តូរ៉ូតផ្នែកមួយនៃ VLDL ត្រូវបានប្តូរទៅជាសំណល់ VLDL ដែលត្រូវបានគេហៅថា lipoproteins ដង់ស៊ីតេកម្រិតមធ្យម (VLDL) ការដកយកចេញនូវសារធាតុ triacylglycerols ពី VLDL ផ្តល់ឱ្យ lipoproteins ដង់ស៊ីតេទាប (អិល។ អិល។ អិល។ ) (ផ្ទាំង ២១-១) ។ ប្រភាគអិល។ អិល។ ដែលសំបូរទៅដោយកូលេស្តេរ៉ុលនិងកូលេស្តេរ៉ុលនិងមានផ្ទុក apoB-100 ផងដែរផ្ទេរកូលេស្តេរ៉ុលទៅជាលិកាខាងក្រៅដែលផ្ទុកអ្នកទទួលជាក់លាក់ដែលទទួលស្គាល់ apoB-100 លើភ្នាសប្លាស្មា។ អ្នកទទួលទាំងនេះសំរបសំរួលការស្រូបយកកូលេស្តេរ៉ុលនិងកូលេស្តេរ៉ុល (ដូចបានរៀបរាប់ខាងក្រោម) ។
បន្ថែម ២១-២ ។អាផិនអាឡែលកំណត់ពីការកើតឡើងនៃជម្ងឺវង្វេងវង្វាន់
នៅក្នុងចំនួនប្រជាជនមានបំរែបំរួលហ្សែនដែលត្រូវបានគេស្គាល់ (បីអេលវែល) នៃពពួកអេប៉ូភីភូត្រូទីនអ៊ី។ ក្នុងចំណោមពពួកអាប៉ូឡូអេលអេលអេលហ្សែលមានលក្ខណៈទូទៅបំផុតនៅក្នុងមនុស្ស (ប្រហែល ៧៨ ភាគរយ) អេលអេអេអ៊ីអ៊ី ៤ និងអេលអូអេអ៊ី ២ គឺ ១៥ និង ៧% រៀងគ្នា។ APOE4 allele គឺជាលក្ខណៈពិសេសរបស់មនុស្សដែលមានជំងឺវង្វេងស្មារតីហើយទំនាក់ទំនងនេះអនុញ្ញាតឱ្យព្យាករណ៍ពីការកើតឡើងនៃជំងឺដោយមានប្រូបាបខ្ពស់។ អ្នកដែលបានទទួលមរតក APOE4 មានហានិភ័យខ្ពស់ក្នុងការវិវត្តទៅជាជំងឺអាល់ហ្សៃមឺរ។ មនុស្ស homozygous សម្រាប់ APOE4 ងាយនឹងវិវត្តទៅជាជំងឺនេះចំនួន ១៦ ដងហើយអាយុជាមធ្យមរបស់អ្នកដែលមានជំងឺគឺមានអាយុប្រហែលជា ៧០ ឆ្នាំ។ ចំពោះមនុស្សដែលទទួលមរតក AROEZ ចំនួនពីរច្បាប់ផ្ទុយទៅវិញអាយុកាលមធ្យមនៃជម្ងឺវង្វេងស្មារតីលើសពី ៩០ ឆ្នាំ។
មូលដ្ឋានម៉ូលេគុលសម្រាប់ការផ្សារភ្ជាប់គ្នារវាងជំងឺ apoE4 និងជំងឺអាល់ហ្សៃមឺរនៅតែមិនទាន់ត្រូវបានគេដឹងនៅឡើយ។ លើសពីនេះទៀតវានៅតែមិនទាន់ច្បាស់ថាតើ apoE4 អាចជះឥទ្ធិពលដល់ការលូតលាស់នៃខ្សែអាមីឡូឌីដែលទំនងជាមូលហេតុនៃជំងឺអាល់ហ្សៃមឺរ (សូមមើលរូបភាពទី ៤-៣១, ខ ១) ។ ការសន្មតផ្តោតលើតួនាទីដែលអាចធ្វើបានរបស់ apoE ក្នុងការធ្វើឱ្យមានស្ថេរភាពនៃរចនាសម្ព័ន្ធស៊ីតូសូសនៃណឺរ៉ូន។ ប្រូតេអ៊ីន apoE2 និង apoEZ ភ្ជាប់ទៅនឹងប្រូតេអ៊ីនមួយចំនួនដែលត្រូវបានផ្សារភ្ជាប់ជាមួយនឹង microtubules នៃណឺរ៉ូនខណៈដែល apoE4 មិនចង។ នេះអាចពន្លឿនការស្លាប់របស់ណឺរ៉ូន។ អ្វីក៏ដោយដែលយន្តការនេះអាចប្រែក្លាយជាការសង្កេតទាំងនេះផ្តល់ក្តីសង្ឃឹមសម្រាប់ការពង្រីកការយល់ដឹងរបស់យើងអំពីមុខងារជីវសាស្រ្តរបស់អាប៉ូប៉ូភីត្រា។
lipoproteins ប្រភេទទី ៤ - lipoproteins ដង់ស៊ីតេខ្ពស់ (HDL), ប្រភាគនេះត្រូវបានបង្កើតឡើងនៅក្នុងថ្លើមនិងពោះវៀនតូចក្នុងទម្រង់ជាភាគល្អិតដែលសំបូរទៅដោយជាតិប្រូតេអ៊ីនតិចតួចដែលមានផ្ទុកនូវកូលេស្តេរ៉ុលតិចតួចនិងគ្មានកូលេស្តេរ៉ុលពេញលេញ (រូបភាព ២១-៤០) ។ ប្រភាគ HDL មាន apoA-I, apoC-I, apoC-II និង apolipoproteins ផ្សេងទៀត (តារាង ២១-២) ក៏ដូចជា lecithin-cholesterol-acyltransferase (LC AT), ដែលជម្រុញការបង្កើតកូលេស្តេរ៉ុលស្តេរ៉ូអ៊ីតពី lecithin (phosphatidylcholine) និងកូលេស្តេរ៉ុល (រូបភាព ២១-៤១) ។ L CAT នៅលើផ្ទៃនៃភាគល្អិត HDL ដែលទើបនឹងបង្កើតថ្មីបានបំលែងកូលេស្តេរ៉ុលនិងសារធាតុ phosphatidylcholine និង VLDL ទៅជាអេសស្ត្រូជែនកូលេស្តេរ៉ុលដែលចាប់ផ្តើមបង្កើតជាស្នូលដោយបំលែងភាគថាស HDL ដែលបង្កើតថ្មីទៅជាភាគ HDL ស្វ៊ែរ។ lipoprotein ដែលមានកូលេស្តេរ៉ុលនេះត្រូវបានត្រលប់ទៅរកថ្លើមដែលកូលេស្តេរ៉ុលត្រូវបានរំសាយកូលេស្តេរ៉ុលមួយចំនួនត្រូវបានបំលែងទៅជាអំបិលទឹកប្រមាត់។
រូបភព។ ២១-៤១ ។ ប្រតិកម្មបណ្តាលមកពីឡាក់ទ្រីន - កូលេស្តេរ៉ុល - acyltransferase (L CAT) ។ អង់ស៊ីមនេះមានវត្តមាននៅលើផ្ទៃនៃភាគល្អិត HDL និងត្រូវបានធ្វើឱ្យសកម្មដោយអាប៉ូអេ - 1 (សមាសធាតុនៃប្រភាគ HDL) ។ កូលេស្តេរ៉ុលអេស្ត្រូសែនកកកុញនៅខាងក្នុងភាគល្អិត HDL ដែលទើបនឹងបង្កើតថ្មីដែលប្រែជា HDL ចាស់ទុំ។

HDL អាចត្រូវបានស្រូបចូលទៅក្នុងថ្លើមដោយការទទួលការព្យាបាលដោយអរម៉ូន endocytosis ប៉ុន្តែយ៉ាងហោចណាស់កូលេស្តេរ៉ុល HDL ត្រូវបានបញ្ជូនទៅជាលិកាដោយយន្តការផ្សេងទៀត។ ភាគល្អិត HDL អាចភ្ជាប់ទៅអេសអេស - ប្រូតេអ៊ីនទទួលវីតាមីននៅលើភ្នាសប្លាស្មានៃកោសិកាថ្លើមនិងក្នុងជាលិកាស្តេរ៉ូអ៊ីតដូចជាក្រពេញ Adrenal ។ អ្នកទទួលទាំងនេះមិនសំរបសំរួល endocytosis ទេប៉ុន្តែការផ្ទេរកូឡេស្តេរ៉ុលនិងផ្នែកខ្លះនៃភាគ HDL ចូលទៅក្នុងកោសិកា។ ប្រភាគ HDL ដែលខ្សោះជីវជាតិបន្ទាប់មកចូលទៅក្នុងចរន្តឈាមជាកន្លែងដែលវារួមបញ្ចូលផ្នែកថ្មីនៃជាតិខ្លាញ់ពីសារធាតុ Chylomicrons និងសំណល់ VLDL ។ HDL ដូចគ្នានេះក៏អាចចាប់យកកូលេស្តេរ៉ុលដែលផ្ទុកនៅក្នុងជាលិកាពិសេសនិងផ្ទេរវាទៅថ្លើមបានដែរ ការដឹកជញ្ជូនកូលេស្តេរ៉ុលបញ្ច្រាស (រូបភាព ២១-៤០) ។ នៅក្នុងវ៉ារ្យ៉ង់នៃការដឹកជញ្ជូនបញ្ច្រាសមួយនៃអន្តរកម្មនៃលទ្ធផល HDL ជាមួយនឹងការទទួលអេស។ ប៊ី។ ប៊ីនៅក្នុងកោសិកាដែលមានកូលេស្តេរ៉ុលចាប់ផ្តើមមានការសាយភាយកូលេស្តេរ៉ុលអកម្មពីផ្ទៃកោសិកាទៅជាភាគល្អិត HDL បន្ទាប់មកផ្ទេរកូលេស្តេរ៉ុលត្រឡប់ទៅថ្លើមវិញ។ នៅក្នុងវ៉ារ្យ៉ង់មួយទៀតនៃការបញ្ចូនបញ្ច្រាសនៅក្នុងកោសិកាកូលេស្តេរ៉ុលបន្ទាប់ពីការបោសសំអាត HDL, apoA-I ធ្វើអន្តរកម្មជាមួយអ្នកដឹកជញ្ជូនសកម្មគឺប្រូតេអ៊ីន ABC ។ អាប៉ូអេ - អាយ (និងសន្មត HDL) ត្រូវបានស្រូបយកដោយជំងឺ endocytosis បន្ទាប់មកត្រូវបានគេលាក់ម្តងទៀតផ្ទុកទៅដោយកូលេស្តេរ៉ុលដែលត្រូវបានដឹកទៅថ្លើម។
ប្រូតេអ៊ីន ABC1 គឺជាផ្នែកមួយនៃក្រុមគ្រួសារធំនៃថ្នាំជាច្រើនក្រុមហ៊ុនដឹកជញ្ជូនទាំងនេះពេលខ្លះត្រូវបានគេហៅថាអ្នកដឹកជញ្ជូនអេប៊ីអេចាប់តាំងពីពួកគេទាំងអស់មានផ្ទុកកាសែតអេធីភី - អេអេសភី (អេភីភី - កាសែតចង) ពួកគេក៏មានដែនបញ្ជូនពីរដែលមានឧបករណ៍ជំនួយបញ្ជូនបន្តចំនួនប្រាំមួយ (សូមមើលចាប) ។ ១១, ខ ១) ។ ប្រូតេអ៊ីនទាំងនេះផ្ទេរអ៊ីយ៉ុងជាច្រើនអាស៊ីដអាមីណូវីតាមីនអរម៉ូនស្តេរ៉ូអ៊ីតនិងអំបិលទឹកប្រមាត់តាមរយៈភ្នាសផ្លាស្មា។ អ្នកតំណាងម្នាក់ទៀតនៃក្រុមអ្នកដឹកជញ្ជូនគ្រួសារនេះគឺប្រូតេអ៊ីន CFTR ដែលមានជម្ងឺប្រូស្តាតត្រូវបានខូចខាត (សូមមើលបន្ថែម ១១-៣, ខ ១) ។
តេស្តូស្តេរ៉ុលចូលក្នុងកោសិកាតាមរយៈការទទួលការព្យាបាលដោយអរម៉ូន endocytosis
ភាគល្អិតនៃអិល។ អិល។ អិលនីមួយៗនៅក្នុងចរន្តឈាមមាន apoB-100 ដែលត្រូវបានទទួលស្គាល់ដោយប្រូតេអ៊ីនទទួលយកផ្ទៃជាក់លាក់ -អ្នកទទួលអិល។ អិល។ អិល នៅលើភ្នាសកោសិកាដែលត្រូវការចាប់កូលេស្តេរ៉ុល។ ការផ្សារភ្ជាប់នៃអិល។ អិល។ អិលទៅនឹងអ្នកទទួលអិល។ អិល។ អិលចាប់ផ្តើមដំណើរការជំងឺ endocytosis ដោយសារតែដែលអិល។ អិល។ អិល។ និងឧបករណ៍ទទួលរបស់វារំកិលចូលទៅក្នុងកោសិកាខាងក្នុងនៃរូបភាព (រូបភាព ២១-៤២) ។ នៅទីបំផុតវត្ថុនេះលាយជាមួយលីស្យូមដែលផ្ទុកនូវអង់ស៊ីមដែលជួយរំលាយជាតិខ្លាញ់កូលេស្តេរ៉ុលបញ្ចេញកូលេស្តេរ៉ុលនិងអាស៊ីតខ្លាញ់ចូលទៅក្នុងស៊ីតូកូល។ ApoB-100 មកពីអិល។ អិល។ អិលក៏បំបែកទៅជាអាស៊ីតអាមីណូដែលត្រូវបានបញ្ចូលទៅក្នុងស៊ីតូសូលប៉ុន្តែអ្នកទទួលអិល។ អិលជៀសវាងការរិចរិលហើយត្រឡប់ទៅផ្ទៃកោសិកាវិញដើម្បីចូលរួមម្តងទៀតក្នុងការស្រូបយកអិល។ អិល។ អិល។ ApoB-100 មានវត្តមាននៅក្នុង VLDL ផងដែរប៉ុន្តែដែនភ្ជាប់របស់វាមិនអាចភ្ជាប់ទៅនឹងឧបករណ៍ទទួលអិលអិលអិលបានទេការបំលែង VLDLP ទៅអិលអិលអិលធ្វើឱ្យដែនភ្ជាប់ដែលអាចទទួលបានទៅជា apoB-100 ។ ដំណើរនៃការដឹកជញ្ជូនកូលេស្តេរ៉ុលក្នុងឈាមនិងការទទួលយកការសម្របសម្រួលដែលមាននៅក្នុងជាលិកាគោលដៅត្រូវបានសិក្សាដោយម៉ៃឃើលប្រោននិងយ៉ូសែបហ្គោលស្ទីន។
ម៉ៃឃើលប្រោននិងយ៉ូសែបហ្គោលស្ទីន

រូបភព។ ២១-៤២ ។ ការចាប់យកកូលេស្តេរ៉ុលដោយការទទួល - អរម៉ូន endocytosis ។

កូលេស្តេរ៉ុលដែលចូលក្នុងកោសិកាតាមវិធីនេះអាចត្រូវបានដាក់បញ្ចូលទៅក្នុងភ្នាសឬកំណត់ឡើងវិញដោយអេទីអេ (រូបភាពទី ២១-៣៨) សម្រាប់ផ្ទុកនៅក្នុងស៊ីតូកូលក្នុងដំណក់ទឹកមាត់។ នៅពេលមានកូឡេស្តេរ៉ុលគ្រប់គ្រាន់នៅក្នុងប្រភាគនៃឈាមអិល។ ឌី។ អេសការប្រមូលផ្តុំនៃកូលេស្តេរ៉ុលលើសត្រូវបានរារាំងដោយកាត់បន្ថយអត្រានៃការសំយោគរបស់វា។
អ្នកទទួលអិល។ អិល។ អិលក៏ភ្ជាប់ទៅនឹង apoE និងដើរតួយ៉ាងសំខាន់ក្នុងការស្រូបយកសារធាតុ chylomicrons និង VLDL ដែលនៅសេសសល់ដោយថ្លើម។ ទោះយ៉ាងណាក៏ដោយប្រសិនបើអ្នកទទួលអិល។ អិល។ អិលមិនអាចប្រើបាន (ឧទាហរណ៍ក្នុងខ្សែកណ្តុរដែលមានហ្សែនអិលអេសអិលដែលបាត់) សំណល់ VLDL និងសារធាតុលីលីណូម្យូននៅតែត្រូវបានស្រូបយកដោយថ្លើមទោះបីជាអិលអិលអិលមិនត្រូវបានស្រូបយកក៏ដោយ។ នេះចង្អុលបង្ហាញពីវត្តមាននៃប្រព័ន្ធបម្រុងជំនួយសម្រាប់ការស្រូបយកអរម៉ូន endocytosis នៃសំណល់ VLDL និង chylomicron ។ អ្នកទទួលបម្រុងមួយគឺប្រូតេអ៊ីនអិល។ អិល។ អេ។ ភី។ ភី។ (ប្រូតេអ៊ីនដែលទាក់ទងនឹង lipoprotein - ដែលទាក់ទងនឹងការទទួល lipoprotein ដែលភ្ជាប់ទៅនឹង apoE និងចំនួននៃសរសៃចងផ្សេងទៀត។
កម្រិតជាច្រើននៃបទប្បញ្ញត្តិជីវគីមីជីវគីមីកូលេស្តេរ៉ុល
ការសំយោគកូឡេស្តេរ៉ុលគឺជាដំណើរការស្មុគស្មាញនិងមានតម្លៃថ្លៃដូច្នេះវាច្បាស់ណាស់ថារាងកាយមានអត្ថប្រយោជន៍ក្នុងការមានយន្តការសម្រាប់ធ្វើនិយតកម្មជីវគីមីកូឡេស្តេរ៉ុលដែលបំពេញបន្ថែមបរិមាណរបស់វាបន្ថែមលើអ្វីដែលភ្ជាប់មកជាមួយអាហារ។ នៅក្នុងថនិកសត្វការផលិតកូលេស្តេរ៉ុលត្រូវបានគ្រប់គ្រងដោយការផ្តោតអារម្មណ៍ intracellular
កូលេស្តេរ៉ុលនិងអរម៉ូន glucagon និងអាំងស៊ុយលីន។ ដំណាក់កាលនៃការបំលែង HMG - CoA ទៅ mevalonate (រូបភាព ២១-៣៤) កំណត់ល្បឿនក្នុងផ្លូវមេតាប៉ូលីសនៃការបង្កើតកូលេស្តេរ៉ុល (ចំណុចសំខាន់នៃបទប្បញ្ញត្តិ) ។ ប្រតិកម្មនេះត្រូវបានបង្កើតឡើងដោយ HMG - CoA reductase ។ បទបញ្ញត្តិឆ្លើយតបទៅនឹងការផ្លាស់ប្តូរកម្រិតកូលេស្តេរ៉ុលត្រូវបានសម្របសម្រួលដោយប្រព័ន្ធបទបញ្ញត្តិនៃការបញ្ជូនចម្លងដ៏ឆើតឆាយសម្រាប់ហ្សែនហ្សែន HMG - CoA reductase ។ ហ្សែននេះរួមជាមួយនឹងអង់ហ្ស៊ីមហ្សែនជាង ២០ ផ្សេងទៀតដែលពាក់ព័ន្ធនឹងការស្រូបយកនិងការសំយោគកូលេស្តេរ៉ុលនិងអាស៊ីតខ្លាញ់មិនឆ្អែតត្រូវបានគ្រប់គ្រងដោយក្រុមគ្រួសារតូចមួយនៃប្រូតេអ៊ីនដែលគេហៅថាប្រូតេអ៊ីនដែលមានអន្តរកម្មជាមួយនឹងធាតុផ្សំនៃស្តេរ៉ូអ៊ីតនៃប្រូតេអ៊ីន (SREBP, ប្រូតេអ៊ីនដែលមានធាតុផ្សំនៃសារធាតុ sterol) ។ ។ បន្ទាប់ពីការសំយោគប្រូតេអ៊ីនទាំងនេះត្រូវបានណែនាំទៅក្នុង reticulum endoplasmic ។ ដែន SREBP ដែលមានសារធាតុរំលាយអាមីណូ - រលាយតែមួយគត់ជាអ្នកធ្វើប្រតិចារិកដោយប្រើយន្តការដែលបានពិពណ៌នានៅក្នុងក្រុមហ៊ុន Ch ។ ២៨ (ខ ៣) ។ ទោះយ៉ាងណាក៏ដោយដែននេះមិនមានលទ្ធភាពចូលទៅក្នុងស្នូលហើយមិនអាចចូលរួមក្នុងដំណើរការនៃហ្សែនបានដរាបណាវាស្ថិតនៅក្នុងម៉ូលេគុលអេសអេស។ ដើម្បីធ្វើឱ្យសកម្មការចម្លងនៃហ្សែន HMG - CoA reductase និងហ្សែនដទៃទៀតដែនសកម្មដែលត្រូវបានផ្ទេរត្រូវបានបំបែកចេញពី SREBP ដែលនៅសល់ដោយការបោសសំអាត proteolytic ។ នៅពេលកូលេស្តេរ៉ុលឡើងខ្ពស់ប្រូតេអ៊ីន SREBP គឺអសកម្មដែលត្រូវបានជួសជុលនៅលើអេសអេសក្នុងស្មុគស្មាញជាមួយប្រូតេអ៊ីនមួយផ្សេងទៀតដែលមានឈ្មោះថាអេសអេស (អេស - ភី - ប្រូតេអ៊ីនសកម្ម) (រូបភាព ២១-៤៣) ។ វាគឺជាអេសអេសអេសដែលភ្ជាប់កូលេស្តេរ៉ុលនិងចំនួនស្តេរ៉ូអ៊ីតផ្សេងទៀតដើរតួជាឧបករណ៏ស្តេរ៉ូអ៊ីត។ នៅពេលដែលកំរិតស្តេរ៉ូអ៊ីតឡើងខ្ពស់ SCAP - SREBP ស្មុគស្មាញអាចមានអន្តរកម្មជាមួយប្រូតេអ៊ីនមួយផ្សេងទៀតដែលធ្វើអោយស្មុគស្មាញដល់អេស។ នៅពេលដែលកម្រិតនៃស្តេរ៉ូអ៊ីតនៅក្នុងកោសិកាធ្លាក់ចុះការផ្លាស់ប្តូរស្របតាមអេសភីអេសនាំឱ្យបាត់បង់សកម្មភាពរក្សាទុកហើយអេសអេសអេស - អេសអេសភីស្មុគស្មាញផ្លាស់ប្តូរនៅខាងក្នុងអូវុលទៅស្មុគស្មាញហ្គីជី។ នៅក្នុងស្មុគស្មាញហ្គីហ្គីប្រូតេអ៊ីនអេសអេសភីភីត្រូវបានពនលាយពីរដងដោយសារធាតុការពារខុសគ្នាពីរគឺការបោសសំអាតទីពីរបញ្ចេញដែនអាមីណូ - ចូលទៅក្នុងស៊ីតូកូល។ ដែននេះផ្លាស់ទីទៅស្នូលហើយធ្វើឱ្យមានការចម្លងហ្សែនគោលដៅ។ ដែនប្រូតេអ៊ីនអេសអេមប៊ីអេស - ស្ថានីយមានអាយុកាលពាក់កណ្តាលជីវិតហើយត្រូវបានបំផ្លាញយ៉ាងឆាប់រហ័សដោយសារធាតុប្រូម៉ាស (សូមមើលរូប ២៧-៤៨, ទំព័រ ៣) ។ នៅពេលដែលកម្រិតស្តេរ៉ូអ៊ីតកើនឡើងគ្រប់គ្រាន់ការបញ្ចេញប្រូតេអីននៃដែនប្រូតេអ៊ីនអេសអេអេភីភីជាមួយអាមីណូមីញ៉ូមត្រូវបានរារាំងម្តងទៀតហើយការបំផ្លាញសារធាតុ proteasome នៃដែនសកម្មដែលមានស្រាប់នាំឱ្យមានការបិទយ៉ាងឆាប់រហ័សនៃហ្សែនគោលដៅ។
រូបភព។ ២១-៤៣ ។ ការធ្វើឱ្យអេសអេអេភីភីសកម្ម។ ប្រូតេអ៊ីន SREB P ធ្វើអន្តរកម្មជាមួយធាតុដែលកំណត់ដោយស្តេរ៉ូអ៊ីត (ពណ៌បៃតង) ភ្លាមៗបន្ទាប់ពីការសំយោគត្រូវបានបញ្ចូលទៅក្នុងអេសអេលបង្កើតជាស្មុគស្មាញជាមួយអេសអេស (ពណ៌ក្រហម) ។ (N និង C តំណាងឱ្យចុងអាម៉ូញាក់និងខារ៉ូលីលនៃប្រូតេអ៊ីន។ ) នៅក្នុងរដ្ឋដែលជាប់ព្រំប្រទល់ S-CAP, ប្រូតេអ៊ីន SRE BP គឺអសកម្ម។ នៅពេលដែលកម្រិតស្តេរ៉ូអ៊ីតមានការថយចុះអេសអ៊ីអេមភី - អេសអេសអេលអេលអេសអេលអេលអេលអេលអេលអេលអេលអេលអេលអេលអេសអេលអេសអេលអេសអេលអេសអេសអេលអេសអេសអេសអេលអេសអេលអេសអេសអេសអេសអេសអេសអេសអេសអេសអេសអេសអេសអេសអេសអេសអេសអេសអេសអេសអេស។ ដែនប្រូតេអ៊ីនអេកូអេសភីអេប៊ីភីដែលត្រូវបានរំដោះបានធ្វើចំណាកស្រុកទៅរកនុយក្លេអ៊ែរដែលវាធ្វើឱ្យមានការផ្លាស់ប្តូរហ្សែនហ្សែនដែលគ្រប់គ្រងដោយស្តេរ៉ូអ៊ីត។

ការសំយោគកូលេស្តេរ៉ុលក៏ត្រូវបានកំណត់ដោយយន្តការជាច្រើនទៀត (រូបភាព ២១-៤៤) ។ ការគ្រប់គ្រងអរម៉ូនត្រូវបានសម្របសម្រួលដោយការផ្លាស់ប្តូរដ៏មានឥទ្ធិពលនៃអិមអិមអេជ - ស៊ីអាដាស៊ីស៊ី។ អង់ស៊ីមនេះមានទម្រង់ជា phosphorylated (អសកម្ម) និង dephosphorylated (សកម្ម) ។ គ្លូកូករំញោចការ phosphorylation (អសកម្ម) នៃអង់ស៊ីមហើយអាំងស៊ុយលីនជំរុញឱ្យមាន dephosphorylation ធ្វើឱ្យអង់ស៊ីមសកម្មនិងជួយសំយោគកូលេស្តេរ៉ុល។ ការប្រមូលផ្តុំកូលេស្តេរ៉ុលខ្ពស់ធ្វើឱ្យអេអេសអេសដែលបង្កើនការធ្វើឱ្យប្រសើរឡើងនៃកូលេស្តេរ៉ុលសម្រាប់ការធ្លាក់ចុះ។ ទីបំផុតកម្រិតកូឡេស្តេរ៉ុលក្នុងកោសិកាខ្ពស់រារាំងការចម្លងហ្សែនដែលភ្ជាប់ទៅនឹងការទទួលអិល។ អិល។ អេ។ កាត់បន្ថយការផលិតរបស់អ្នកទទួលនេះហើយដូច្នេះការស្រូបយកកូលេស្តេរ៉ុលចេញពីឈាម។
រូបភព។ ២១-៤៤ ។ បទបញ្ញត្តិកម្រិតកូលេស្តេរ៉ុលផ្តល់នូវតុល្យភាពរវាងការសំយោគនិងការស្រូបយកកូលេស្តេរ៉ុលពីអាហារ។ គ្លូកូកជួយសម្របសម្រួល phosphorylation (អសកម្ម) នៃ NM G -CoA reductase, អាំងស៊ុយលីនជួយលើកកម្ពស់ការធ្វើឱ្យថយចុះកម្តៅ (ធ្វើឱ្យសកម្ម) ។ X - មេតាប៉ូលីសកូឡេស្តេរ៉ុលដែលមិនត្រូវបានកំណត់អត្តសញ្ញាណដែលរំញោចការធ្វើឱ្យប្រូសេស្តេរ៉ូននៃអេមអេមអេជ - អេអាឌីស៊ីស្តាស៊ីស។

កូលេស្តេរ៉ុលដែលមិនមានការគ្រប់គ្រងអាចបណ្តាលឱ្យមានជំងឺធ្ងន់ធ្ងរនៅក្នុងខ្លួនមនុស្ស។ នៅពេលបរិមាណកូលេស្តេរ៉ុលនិងកូលេស្តេរ៉ុលដែលទទួលបានពីអាហារលើសពីបរិមាណដែលត្រូវការសម្រាប់ការប្រមូលផ្តុំភ្នាសការសំយោគអំបិលទឹកប្រមាត់និងស្តេរ៉ូអ៊ីតការប្រមូលផ្តុំជាតិកូឡេស្តេរ៉ុលក្នុងសរសៃឈាម (បន្ទះក្រិនសរសៃឈាមអាចលេចឡើង) ដែលនាំឱ្យមានការស្ទះ (atherosclerosis) ។ នៅក្នុងប្រទេសឧស្សាហកម្មវាគឺជាជំងឺខ្សោយបេះដូងដោយសារតែការស្ទះសរសៃឈាមបេះដូងដែលជាមូលហេតុចម្បងនៃការស្លាប់។ ការវិវត្តនៃជំងឺ atherosclerosis ត្រូវបានផ្សារភ្ជាប់ជាមួយនឹងកម្រិតខ្ពស់នៃកូលេស្តេរ៉ុលក្នុងឈាមនិងជាពិសេសជាមួយនឹងកម្រិតខ្ពស់នៃកូឡេស្តេរ៉ុលដែលបានផ្ទេរជាមួយនឹងប្រភាគ LDL និងកម្រិតខ្ពស់នៃឈាម HDL ផ្ទុយទៅវិញធ្វើឱ្យប៉ះពាល់ដល់ស្ថានភាពនៃសរសៃឈាម។
ជាមួយនឹង hypercholesterolemia តំណពូជ (ជម្ងឺហ្សែន) កម្រិតនៃកូលេស្តេរ៉ុលក្នុងឈាមគឺខ្ពស់ណាស់ - ជំងឺក្រិនថ្លើមធ្ងន់ធ្ងរកើតមានចំពោះមនុស្សទាំងនេះរួចទៅហើយក្នុងវ័យកុមារភាព។ ដោយសារតែការទទួល LDL ដែលមានបញ្ហាការទទួលយកកូលេស្តេរ៉ុល LDL ដែលមិនទទួលបានគ្រប់គ្រាន់អាចកើតឡើង។ ជាលទ្ធផលកូលេស្តេរ៉ុលមិនត្រូវបានយកចេញពីចរន្តឈាមទេវាកកកុញនិងរួមចំណែកដល់ការបង្កើតបន្ទះ atherosclerotic ។ ការសំយោគកូលេស្តេរ៉ុលដែលបង្ករកំណើតនៅតែបន្តទោះបីមានកូលេស្តេរ៉ុលលើសនៅក្នុងឈាមក៏ដោយព្រោះកូលេស្តេរ៉ុលបន្ថែមមិនអាចចូលក្នុងកោសិកាដើម្បីគ្រប់គ្រងសំយោគ intracellular (រូបភាព ២១-៤៤) ។សម្រាប់ការព្យាបាលនៃអ្នកជំងឺដែលមាន hypercholesterolemia តំណពូជនិងជំងឺដទៃទៀតដែលត្រូវបានផ្សារភ្ជាប់ជាមួយនឹងការកើនឡើងកូលេស្តេរ៉ុល, កម្រិតថ្នាំ Statin ត្រូវបានប្រើ។ ពួកគេខ្លះទទួលបានពីប្រភពធម្មជាតិរីឯខ្លះទៀតត្រូវបានសំយោគដោយឧស្សាហកម្មឱសថ។ ថ្នាំ Statins គឺស្រដៀងគ្នាទៅនឹង mevalonate (បន្ថែម ២១-៣) និងជាអ្នករារាំងការប្រកួតប្រជែងនៃ NMS-CoA reductase ។
ការបន្ថែម ២១-៣ ។ មេឌា។ សម្មតិកម្ម lipid និងការបង្កើតថ្នាំស្តាទីន
ជំងឺសរសៃឈាមបេះដូង (CHD) គឺជាបុព្វហេតុចម្បងនៃការស្លាប់នៅក្នុងប្រទេសអភិវឌ្ឍន៍។ សរសៃឈាមតូចចង្អៀតដែលផ្ទុកឈាមទៅបេះដូងកើតឡើងដោយសារការបង្កើតស្រទាប់ខ្លាញ់ដែលគេហៅថាបន្ទះ atherosclerotic បន្ទះទាំងនេះមានកូលេស្តេរ៉ុលប្រូតេអ៊ីន fibrillar កាល់ស្យូមកំណកឈាមនិងបំណែកកោសិកា។ នៅសតវត្សទី XX ។ មានការជជែកវែកញែកយ៉ាងសកម្មអំពីទំនាក់ទំនងរវាងការស្ទះសរសៃឈាមអាកទែរ (សរសៃឈាមបេះដូង) និងកូលេស្តេរ៉ុលក្នុងឈាម។ ការពិភាក្សាទាំងនេះនិងការស្រាវជ្រាវសកម្មក្នុងទិសដៅនេះបាននាំឱ្យមានការបង្កើតថ្នាំដែលមានប្រសិទ្ធភាពបន្ថយកូលេស្តេរ៉ុល។
នៅឆ្នាំ ១៩១៣ អេននីកកូអ្នកវិទ្យាសាស្ត្រនិងជំនាញខាងវិទ្យាសាស្ត្ររុស្ស៊ីដ៏ល្បីល្បាញខាងវិទ្យាសាស្ត្រពិសោធន៍បានចេញផ្សាយការងារមួយដែលគាត់បានបង្ហាញថាទន្សាយចិញ្ចឹមជាមួយអាហារដែលមានជាតិខ្លាញ់កូឡេស្តេរ៉ុលបង្កើតការខូចខាតដល់សរសៃឈាមដែលស្រដៀងនឹងបន្ទះ atherosclerotic នៅក្នុងនាវារបស់មនុស្សចាស់។ លោក Anichkov បានធ្វើការស្រាវជ្រាវអស់រយៈពេលជាច្រើនទស្សវត្សរ៍ហើយបានបោះពុម្ពផ្សាយលទ្ធផលនៅក្នុងទិនានុប្បវត្តិល្បីរបស់លោកខាងលិច។ ជាអកុសលទិន្នន័យរបស់គាត់មិនបានក្លាយជាមូលដ្ឋានសម្រាប់គំរូនៃការវិវត្តនៃជំងឺក្រិនសរសៃឈាមចំពោះមនុស្សនោះទេព្រោះនៅពេលនោះសម្មតិកម្មបានបង្ហាញថាជំងឺនេះគឺជាលទ្ធផលធម្មជាតិនៃភាពចាស់ហើយមិនអាចទប់ស្កាត់បាន។ ទោះយ៉ាងណាក៏ដោយភស្តុតាងត្រូវបានប្រមូលផ្តុំជាបណ្តើរ ៗ នៃទំនាក់ទំនងរវាងកូលេស្តេរ៉ុលនិងការវិវត្តនៃជំងឺ atherosclerosis (សម្មតិកម្ម lipid) និងនៅទសវត្សឆ្នាំ ១៩៦០ ។ អ្នកស្រាវជ្រាវខ្លះបានបញ្ជាក់យ៉ាងច្បាស់ថាជំងឺនេះអាចត្រូវបានព្យាបាលដោយថ្នាំ។ ទោះជាយ៉ាងណាក៏ដោយទស្សនៈផ្ទុយគ្នាមានរហូតដល់ការបោះពុម្ពផ្សាយនៅឆ្នាំ ១៩៨៤ នៃលទ្ធផលនៃការសិក្សាទូលំទូលាយអំពីតួនាទីនៃកូលេស្តេរ៉ុលដែលត្រូវបានធ្វើឡើងដោយវិទ្យាស្ថានសុខភាពជាតិសហរដ្ឋអាមេរិក (ការសាកល្បងការពារបឋមនៃសរសៃឈាមបេះដូង) ។ ការថយចុះគួរឱ្យកត់សំគាល់តាមស្ថិតិនៃប្រេកង់នៃការរំលោភបំពានឈាមរត់និងជំងឺដាច់សរសៃឈាមខួរក្បាលជាមួយនឹងការថយចុះកូលេស្តេរ៉ុលក្នុងឈាមត្រូវបានបង្ហាញ។ នៅក្នុងការសិក្សានេះកូលេស្តេរ៉ុលដែលជាជ័រផ្លាស់ប្តូរអ៊ីណុកដែលភ្ជាប់អាស៊ីតទឹកប្រមាត់ត្រូវបានគេប្រើដើម្បីបន្ថយកូលេស្តេរ៉ុល។ លទ្ធផលបានជំរុញការស្វែងរកថ្នាំព្យាបាលដែលមានឥទ្ធិពលថ្មី។ ខ្ញុំត្រូវតែនិយាយថានៅក្នុងពិភពវិទ្យាសាស្ត្រមានការសង្ស័យអំពីសុពលភាពនៃសម្មតិកម្ម lipid បានបាត់ទៅវិញទាំងស្រុងតែជាមួយនឹងការមកដល់នៃថ្នាំស្តាទីននៅចុងទសវត្សឆ្នាំ ១៩៨០ - ដើមទសវត្សឆ្នាំ ១៩៩០ ។
ស្តាទីនដំបូងត្រូវបានរកឃើញដោយអាគីរ៉ា Endo នៅសង្ក្រាន្តក្នុងទីក្រុងតូក្យូ។ អេនដូបានបោះពុម្ពផ្សាយស្នាដៃរបស់គាត់ក្នុងឆ្នាំ ១៩៧៦ ទោះបីជាគាត់បានដោះស្រាយបញ្ហានៃការរំលាយអាហារកូលេស្តេរ៉ុលអស់រយៈពេលជាច្រើនឆ្នាំក៏ដោយ។ ក្នុងឆ្នាំ ១៩៧១ គាត់បានណែនាំថាថ្នាំសំយោគកូលេស្តេរ៉ុលអាចមាននៅក្នុងអ្នកផលិតផ្សិតនៃថ្នាំអង់ទីប៊ីយោទិចដែលត្រូវបានសិក្សានៅពេលនោះ។ អស់រយៈពេលជាច្រើនឆ្នាំនៃការងារដែលពឹងផ្អែកខ្លាំងគាត់បានវិភាគលើវប្បធម៌ផ្សិតជាង ៦.០០០ ប្រភេទរហូតដល់គាត់ទទួលបានលទ្ធផលជាវិជ្ជមាន។ សមាសធាតុលទ្ធផលត្រូវបានគេហៅថាបង្រួម។ សារធាតុនេះជួយបញ្ចុះកូឡេស្តេរ៉ូលនៅក្នុងសត្វឆ្កែនិងសត្វស្វា។ ការសិក្សាទាំងនេះទទួលបានការចាប់អារម្មណ៍ពីម៉ៃឃើលប្រោននិងយ៉ូសែបហ្គោស្ទីនថេននៃសាកលវិទ្យាល័យវេជ្ជសាស្ត្រនៃសាកលវិទ្យាល័យ Texas និរតី។ Brown និង Goldstein រួមជាមួយ Endo បានចាប់ផ្តើមការសិក្សារួមគ្នានិងបញ្ជាក់ពីទិន្នន័យរបស់គាត់។ ជោគជ័យធំ ៗ នៃការសាកល្បងគ្លីនិកដំបូងពាក់ព័ន្ធនឹងក្រុមហ៊ុនឱសថក្នុងការអភិវឌ្ឍថ្នាំថ្មីទាំងនេះ។ នៅឯក្រុមហ៊ុន Merck ក្រុមមួយដែលដឹកនាំដោយ Alfred Alberts និង Roy Wagelos បានចាប់ផ្តើមការបញ្ចាំងថ្មីនៃវប្បធម៌ផ្សិតហើយជាលទ្ធផលនៃការវិភាគនៃវប្បធម៌សរុបចំនួន ១៨ បានរកឃើញថ្នាំសកម្មមួយទៀត។ សារធាតុថ្មីត្រូវបានគេហៅថា lovastatin ។ ទោះយ៉ាងណានៅពេលជាមួយគ្នានេះវាត្រូវបានគេជឿជាក់ជាទូទៅថាការគ្រប់គ្រងកម្រិតថ្នាំបង្រួមខ្ពស់ចំពោះសត្វឆ្កែនាំឱ្យមានការវិវត្តនៃជំងឺមហារីកនិងការស្វែងរកថ្នាំ Statins ថ្មីនៅទសវត្សឆ្នាំ ១៩៨០ ។ ត្រូវបានផ្អាក។ ទោះយ៉ាងណានៅពេលនោះអត្ថប្រយោជន៍នៃការប្រើថ្នាំ Statins ដើម្បីព្យាបាលអ្នកជំងឺដែលមានជំងឺទឹកនោមផ្អែមក្នុងគ្រួសារបានបង្ហាញឱ្យឃើញរួចហើយ។ បន្ទាប់ពីមានការពិគ្រោះយោបល់ជាច្រើនជាមួយអ្នកជំនាញអន្តរជាតិនិងរដ្ឋបាលចំណីអាហារនិងឪសថអាមេរិក (អាមេរិចសហរដ្ឋអាមេរិក) ក្រុមហ៊ុន Merck បានចាប់ផ្តើមអភិវឌ្ឍ lovastatin ។ ការសិក្សាយ៉ាងទូលំទូលាយក្នុងរយៈពេលពីរទសវត្សបន្ទាប់មិនបានបង្ហាញពីឥទ្ធិពលនៃសារពាង្គកាយនៃ lovastatin និងថ្នាំជំនាន់ថ្មីដែលបានលេចឡើងបន្ទាប់ពីវា។
រូបភព។ ថ្នាំ Statins គឺជាសារធាតុទប់នៃ NM G-CoA reductase ។ ការប្រៀបធៀបនៃរចនាសម្ព័ន្ធនៃ mevalonate និងផលិតផលឱសថចំនួនបួន (Statin) ដែលរារាំងសកម្មភាពរបស់ NM G -CoA reductase ។

Statins រារាំងសកម្មភាពរបស់អេសប៊ីជី - កូអា - reductase ធ្វើត្រាប់តាមរចនាសម្ព័នរបស់មូស្គូទីណានិងរារាំងការសំយោគកូលេស្តេរ៉ុល។ ចំពោះអ្នកជំងឺដែលមាន hypercholesterolemia ដែលបណ្តាលមកពីកង្វះនៅក្នុងច្បាប់ចម្លងហ្សែនអេសអិលមួយពេលទទួល lovastatin កម្រិតកូឡេស្តេរ៉ុលត្រូវបានកាត់បន្ថយ ៣០ ភាគរយ។ ថ្នាំនេះកាន់តែមានប្រសិទ្ធភាពក្នុងការរួមផ្សំជាមួយជ័រពិសេសដែលភ្ជាប់អាស៊ីតទឹកប្រមាត់និងការពារការស្រូបយកបញ្ច្រាសពីពោះវៀន។
បច្ចុប្បន្នថ្នាំ Statins ត្រូវបានគេប្រើញឹកញាប់បំផុតដើម្បីបញ្ចុះកូលេស្តេរ៉ុលប្លាស្មាក្នុងឈាម។ នៅពេលប្រើថ្នាំណាមួយសំណួរកើតឡើងអំពីផលប៉ះពាល់ដែលពួកគេមិនចង់បាន។ ទោះយ៉ាងណាក៏ដោយក្នុងករណីថ្នាំ Statins ផលប៉ះពាល់ជាច្រើនផ្ទុយមកវិញគឺវិជ្ជមាន។ ថ្នាំទាំងនេះអាចរំញោចលំហូរឈាមជួសជុលបន្ទះដែលមានរួចទៅហើយ (ដូច្នេះពួកវាមិនបំបែកចេញពីជញ្ជាំងសរសៃឈាមនិងមិនរំខានដល់លំហូរឈាម) រារាំងការប្រមូលផ្តុំប្លាស្មានិងក៏ធ្វើឱ្យដំណើរការរលាកថយចុះនៅជញ្ជាំងសរសៃឈាមផងដែរ។ ចំពោះអ្នកជំងឺដែលប្រើថ្នាំ Statins ជាលើកដំបូងផលប៉ះពាល់ទាំងនេះត្រូវបានបង្ហាញសូម្បីតែមុនពេលកម្រិតកូឡេស្តេរ៉ុលចាប់ផ្តើមថយចុះហើយវាអាចត្រូវបានផ្សារភ្ជាប់ជាមួយនឹងការហាមឃាត់នៃការសំយោគអ៊ីសូតូនីន។ ជាការពិតមិនមែនគ្រប់ផលប៉ះពាល់នៃថ្នាំស្តាទីនសុទ្ធតែមានអត្ថប្រយោជន៍នោះទេ។ ចំពោះអ្នកជំងឺមួយចំនួន (ជាទូទៅក្នុងចំនោមអ្នកដែលប្រើថ្នាំ Statin រួមជាមួយថ្នាំដទៃទៀតដែលបន្ថយកូលេស្តេរ៉ុល) ការឈឺចាប់សាច់ដុំនិងខ្សោយសាច់ដុំអាចកើតមានហើយពេលខ្លះមានទម្រង់រឹងមាំ។ ផលប៉ះពាល់ជាច្រើនទៀតនៃថ្នាំស្តាទីនក៏ត្រូវបានចុះបញ្ជីផងដែរដែលជាសំណាងល្អកម្រកើតមានណាស់។ ភាគច្រើននៃអ្នកជំងឺ, ការប្រើថ្នាំ Statins អាចរារាំងការវិវត្តនៃជំងឺសរសៃឈាមបេះដូង។ ដូចថ្នាំដទៃទៀតដែរថ្នាំ Statins គួរតែត្រូវបានប្រើតាមការណែនាំរបស់វេជ្ជបណ្ឌិត។

ជាមួយនឹងអវត្តមានតំណពូជនៃកូលេស្តេរ៉ុលល្អ HDL, កំរិតកូលេស្តេរ៉ុលគឺទាបណាស់, ជាមួយនឹងជំងឺ Tangier, កូលេស្តេរ៉ុលមិនត្រូវបានកំណត់ទេ។ ជំងឺហ្សែនទាំងពីរបណ្តាលមកពីការផ្លាស់ប្តូរនៅក្នុងប្រូតេអ៊ីន ABC1 ។ ប្រភាគកូឡេស្តេរ៉ុលដែលគ្មាន HDL មិនអាចចាប់យកកូលេស្តេរ៉ុលពីកោសិកាដែលខ្វះ ABC1 បានទេហើយកោសិកាដែលរំលាយកូលេស្តេរ៉ុលត្រូវបានយកចេញពីឈាមយ៉ាងឆាប់រហ័សនិងបំផ្លាញ។ ទាំងអវត្តមានតំណពូជនៃជម្ងឺ HDL និងជំងឺ Tangier គឺកម្រមានណាស់ (តិចជាង ១០០ គ្រួសារដែលមានជំងឺ Tangier ត្រូវបានគេស្គាល់ទូទាំងពិភពលោក) ប៉ុន្តែជំងឺទាំងនេះបង្ហាញពីតួនាទីរបស់ប្រូតេអ៊ីន ABC1 ក្នុងបទបញ្ជានៃកម្រិតប្លាស្មា HDL ។ ដោយសារកម្រិត HDL ប្លាស្មាទាបទាក់ទងទៅនឹងអត្រាខ្ពស់នៃការខូចសរសៃឈាមខួរក្បាលប្រូតេអ៊ីន ABC1 អាចជាគោលដៅមានប្រយោជន៍សម្រាប់ថ្នាំដែលត្រូវបានរចនាឡើងដើម្បីគ្រប់គ្រងកម្រិត HDL ។ ■
អរម៉ូនស្តេរ៉ូអ៊ីតត្រូវបានបង្កើតឡើងដោយបំបែកខ្សែសង្វាក់កូលេស្តេរ៉ុលនិងការកត់សុីរបស់វា។
មនុស្សម្នាក់ទទួលបានអរម៉ូនស្តេរ៉ូអ៊ីតទាំងអស់ពីកូលេស្តេរ៉ុល (រូបភាព ២១-៤៥) ។ អរម៉ូនស្តេរ៉ូអ៊ីតពីរក្រុមត្រូវបានគេសំយោគនៅក្នុងអ័រតូដ្យូដូសៈ សារធាតុរ៉ែខនិជដែលកំណត់ការស្រូបយកអ៊ីយ៉ុងសរីរាង្គ (Na +, C l - និង HC O) 3 -) ក្នុងក្រលៀននិង គ្លូកូកូទីកូឌីស, ដែលជួយគ្រប់គ្រងជាតិស្ករ gluconeogenesis និងកាត់បន្ថយការឆ្លើយតបរលាក។ អ័រម៉ូនភេទត្រូវបានផលិតនៅក្នុងកោសិកាបន្តពូជរបស់បុរសនិងស្ត្រីនិងក្នុងសុក។ ក្នុងចំណោមពួកគេ progesterone ដែលគ្រប់គ្រងវដ្តបន្តពូជស្ត្រី androgens (ឧទាហរណ៍តេស្តូស្តេរ៉ូន) និង អេស្ត្រូសែន (អេស្ត្រូឌីដូល) ដែលជះឥទ្ធិពលដល់ការអភិវឌ្ឍនៃលក្ខណៈផ្លូវភេទបន្ទាប់បន្សំចំពោះបុរសនិងស្ត្រីរៀងៗខ្លួន។ អរម៉ូនស្តេរ៉ូអ៊ីតមានឥទ្ធិពលនៅកម្រិតកំហាប់ទាបហើយដូច្នេះត្រូវបានគេសំយោគក្នុងបរិមាណតិចតួច។ បើប្រៀបធៀបជាមួយអំបិលទឹកប្រមាត់កូលេស្តេរ៉ុលតិចតួចត្រូវបានគេប្រើប្រាស់សម្រាប់ការផលិតអរម៉ូនស្តេរ៉ូអ៊ីត។

រូបភព។ ២១-៤៥ ។ អរម៉ូនស្តេរ៉ូអ៊ីតមួយចំនួនត្រូវបានបង្កើតឡើងពីកូលេស្តេរ៉ុល។ រចនាសម្ព័ន្ធនៃសមាសធាតុមួយចំនួននៃសមាសធាតុទាំងនេះត្រូវបានបង្ហាញនៅក្នុងរូបភព។ ១០-១៩, ខ ១ ។

ការសំយោគអរម៉ូនស្តេរ៉ូអ៊ីតតម្រូវឱ្យមានការដកយកចេញនូវអាតូមកាបូនជាច្រើនឬទាំងអស់នៅក្នុងខ្សែសង្វាក់ចំហៀងនៃកូ-១៧ ឌី - សកូឡេស្តេរ៉ុល។ ការយកចេញនៃខ្សែសង្វាក់ចំហៀងកើតឡើងនៅក្នុងជាលិកាមីតូស៊ីនៀនៃជាលិកាស្តេរ៉ូអ៊ីត។ ដំណើរការនៃការដកយកចេញរួមមានអ៊ីដ្រូសែននៃអាតូមកាបូនដែលនៅជាប់គ្នាពីរនៃខ្សែសង្វាក់ចំហៀង (C-20 និង C-22) បន្ទាប់មកការបោសសំអាតនៃចំណងរវាងពួកវា (រូបភាព ២១-៤៦) ។ ការបង្កើតអរម៉ូនផ្សេងៗក៏រួមបញ្ចូលការណែនាំអាតូមអុកស៊ីសែនផងដែរ។ ប្រតិកម្មអ៊ីដ្រូសែននិងប្រតិកម្មអុកស៊ីតកម្មទាំងអស់ក្នុងកំឡុងពេលធ្វើកោសល្យវិច័យជីវគីមីត្រូវបានបំផ្លាញដោយអុកស៊ីតកម្មមុខងារចម្រុះ (បន្ថែម ២១-១) ដែលប្រើNА D PH, O 2 និងមីតូឆុនថលស៊ីតូក្រូ P-៤៥០ ។
រូបភព។ ២១-៤៦ ។ ការបោសសំអាតនៃខ្សែសង្វាក់ចំហៀងក្នុងការសំយោគអ័រម៉ូនស្តេរ៉ូអ៊ីត។ នៅក្នុងប្រព័ន្ធ oxidase នេះដែលមានមុខងារចម្រុះដែលកត់សុីអាតូមកាបូនដែលនៅជាប់គ្នា cytochrome P-450 ដើរតួជាក្រុមហ៊ុនបញ្ជូនអេឡិចត្រុង។ ចូលរួមក្នុងដំណើរការនេះផងដែរគឺប្រូតេអ៊ីនដឹកជញ្ជូនអេឡិចត្រូនិចអេដ្រូដូណូស៊ីននិងអាដ្រេដូណូណូស៊ីន។ ប្រព័ន្ធនៃការបំបែកច្រវ៉ាក់ចំហៀងនេះត្រូវបានគេរកឃើញនៅក្នុងមីតូឆុនៀនៃអ័រតូដដែលជាកន្លែងដែលការផលិតអរម៉ូនស្តេរ៉ូអ៊ីតកើតឡើង។ Pregnenolone គឺជាភ្នាក់ងារនាំមុខនៃអរម៉ូនស្តេរ៉ូអ៊ីតដទៃទៀត (រូបភាព ២១-៤៥) ។

អន្តរការីជីវគីមីកូឡេស្តេរ៉ុលកូលេស្តេរ៉ុលចូលរួមនៅក្នុងមាគ៌ាមេតាប៉ូលីសជាច្រើនទៀត។
បន្ថែមពីតួនាទីរបស់វាជាសារធាតុជីវគីមីកូឡេស្តេរ៉ុលកម្រិតមធ្យម isopentenyl pyrophosphate ដើរតួជាភ្នាក់ងាររំញោចសកម្មក្នុងការសំយោគជីវឧស្ម័នមួយចំនួនធំដែលបំពេញមុខងារជីវសាស្ត្រផ្សេងៗ (រូបភាព ២១-៤៧) ។ ទាំងនេះរួមមានវីតាមីនអា, អ៊ីនិងខេ, សារធាតុពណ៌រុក្ខជាតិដូចជាខារ៉ូណេននិងខ្សែសង្វាក់ក្លូហ្វីលីលជ័រធម្មជាតិប្រេងសំខាន់ៗជាច្រើន (ឧទាហរណ៍មូលដ្ឋានក្រអូបនៃប្រេងក្រូចឆ្មារអេកកាទិកម៉ុក) អរម៉ូនអនីតិជនសត្វល្អិតដែលធ្វើនិយ័តកម្មមេតាប៉ូលីស, ដូលីកូល។ ដើរតួជាក្រុមហ៊ុនដឹកជញ្ជូនរលាយក្នុងខ្លាញ់ក្នុងការសំយោគស្មុគស្មាញនៃប៉ូលីស្យូសអេទីប៊ីនណុននិងផ្លាតូគីនណុន - ក្រុមហ៊ុនដឹកជញ្ជូនអេឡិចត្រូនិចនៅក្នុងមីតូឆុងសៀនិងក្លរីកូស។ ម៉ូលេគុលទាំងអស់នេះគឺ isoprenoids នៅក្នុងរចនាសម្ព័ន្ធ។ isoprenoids ខុសគ្នាជាង ២ ម៉ឺនត្រូវបានគេរកឃើញនៅក្នុងធម្មជាតិហើយរាប់រយទៀតត្រូវបានរាយការណ៍ជារៀងរាល់ឆ្នាំ។
រូបភព។ ២១-៤៧ រូបភាពទូទៅនៃជីវគីមីនៃ isoprenoids ។ រចនាសម្ព័ននៃផលិតផលចុងក្រោយដែលត្រូវបានបង្ហាញនៅទីនេះត្រូវបានផ្តល់ឱ្យនៅក្នុងចាប។ ១០ (ខ ១) ។

សារធាតុ Prenylation (ការភ្ជាប់ដោយalalនៃអុីណូហ្វេណុសសូមមើលរូបភាព ២៧-៣៥) គឺជាយន្តការទូទៅមួយដែលយុថ្កាប្រូតេអ៊ីននៅលើផ្ទៃខាងក្នុងនៃភ្នាសកោសិកាថនិកសត្វ (សូមមើលរូបភាព ១១-១៤) ។ នៅក្នុងប្រូតេអ៊ីនខ្លះជាតិខ្លាញ់ដែលត្រូវបានផ្សារភ្ជាប់ត្រូវបានតំណាងដោយក្រុម farnesyl ដែលមានជាតិកាបូនចំនួន ១៥ នៅក្នុងអ្នកផ្សេងទៀតវាគឺជាក្រុមភេនទីល geranyl ដែលមានជាតិកាបូន ២០ ។ ជាតិខ្លាញ់ពីរប្រភេទនេះភ្ជាប់អង់ស៊ីមផ្សេងៗគ្នា។ វាអាចទៅរួចដែលថាប្រតិកម្មមុនពេលប្រើប្រូតេអ៊ីនដឹកនាំដោយផ្ទាល់ទៅនឹងភ្នាសផ្សេងៗគ្នាអាស្រ័យលើខ្លាញ់ណាមួយដែលត្រូវបានភ្ជាប់។ ការបំប៉នប្រូតេអ៊ីនគឺជាតួនាទីសំខាន់មួយទៀតសម្រាប់និស្សន្ទវត្ថុ isoprene - អ្នកចូលរួមនៃដំណើររំលាយអាហារកូលេស្តេរ៉ុល។
សេចក្តីសង្ខេបនៃផ្នែកទី ២១.៤ ជីវគីមីនៃកូលេស្តេរ៉ុលស្តេរ៉ូអ៊ីតនិងអ៊ីស្ត្រូស្តេរ៉ូន
កូលេស្តេរ៉ុលត្រូវបានបង្កើតឡើងពីអាសេទីល - កូអានៅក្នុងលំដាប់ប្រតិកម្មស្មុគស្មាញតាមរយៈអន្តរការីដូចជាβ-hydroxy-β-methylglutaryl-CoA, mevalonate, ពីរ isoprene dimethylallyl pyrophosphate និង isopentenyl pyrophosphate ។ ការបង្រួមនៃឯកតាអ៊ីសូរីនផ្តល់ឱ្យ squalene ដែលមិនមែនជាស៊ីក្លូដែលវដ្តបង្កើតបានជាប្រព័ន្ធរោទិ៍ខាប់និងខ្សែសង្វាក់ចំហៀងស្តេរ៉ូអ៊ីត។
synt ការសំយោគកូលេស្តេរ៉ុលស្ថិតនៅក្រោមការគ្រប់គ្រងអ័រម៉ូនហើយលើសពីនេះទៀតវាត្រូវបានរារាំងដោយការកើនឡើងនៃការប្រមូលផ្តុំកូលេស្តេរ៉ុលដែលកើតឡើងតាមរយៈការផ្លាស់ប្តូរ covalent និងបទបញ្ញត្តិនៃការចម្លង។
est កូលេស្តេរ៉ុលនិងកូលេស្តេរ៉ុលត្រូវបានផ្ទុកដោយឈាមដូចជាផ្លាស្មា lipoproteins ប្លាស្មា។ ប្រភាគ VLDL ផ្ទេរកូលេស្តេរ៉ុលតេស្តូស្តេរ៉ូអ៊ីតនិងទ្រីយ៉ាឡាឡឺលីសពីថ្លើមទៅជាលិកាផ្សេងៗទៀតដែលសារធាតុទ្រីយ៉ាល់លីស្តូលីសត្រូវបានបំបែកដោយ lipoprotein lipase និង VLDL ត្រូវបានបំលែងទៅជាអិល។ អិល។ អិល។ ប្រភាគ LDL ដែលសំបូរទៅដោយកូលេស្តេរ៉ុលនិងកូលេស្តេរ៉ុលត្រូវបានចាប់ដោយប្រយោលដោយអ្នកទទួលដោយជំងឺ endocytosis ខណៈពេលដែលអេប៉ូភីប៉ូភូទីននៅក្នុងអិលអិលអិលត្រូវបានទទួលស្គាល់ដោយអ្នកទទួលភ្នាសប្លាស្មា។ HDL យកកូលេស្តេរ៉ុលចេញពីឈាមផ្ទេរវាទៅថ្លើម។ ស្ថានភាពអាហារូបត្ថម្ភឬកង្វះហ្សែនក្នុងការរំលាយអាហារកូលេស្តេរ៉ុលអាចបណ្តាលអោយមានជំងឺក្រិនសរសៃឈាមនិងជំងឺ myocardial infarction ។
■អរម៉ូនស្តេរ៉ូអ៊ីត (glucocorticoids, mineralocorticoids និងអរម៉ូនភេទ) ត្រូវបានបង្កើតឡើងពីកូលេស្តេរ៉ុលដោយផ្លាស់ប្តូរខ្សែសង្វាក់ចំហៀងនិងណែនាំអាតូមអុកស៊ីសែនចូលទៅក្នុងប្រព័ន្ធស្តេរ៉ូអ៊ីត។ សមាសធាតុ isoprenoid ផ្សេងទៀតជាច្រើនត្រូវបានផលិតចេញពី mevalonate ដោយការច្រោះជាតិ isopentenyl pyrophosphate និង dimethylallyl pyrophosphate រួមជាមួយកូលេស្តេរ៉ុល។
ren សារធាតុ Prenylation នៃប្រូតេអ៊ីនជាក់លាក់ដឹកនាំពួកវាទៅកន្លែងភ្ជាប់ជាមួយភ្នាសកោសិកានិងមានសារៈសំខាន់សម្រាប់សកម្មភាពជីវសាស្ត្ររបស់វា។
សំនួរ ៤៨. បទប្បញ្ញត្តិនៃការរំលាយអាហារអាស៊ីដខ្លាញ់ខ្ពស់ (β - កត់សុីនិងជីវគីមី) ។ សំយោគ malonyl CoA ។ Carboxylase Acetyl CoA, បទប្បញ្ញត្តិនៃសកម្មភាពរបស់វា។ ការដឹកជញ្ជូនអៃឡីខូ - អេតាមរយៈភ្នាសខាងក្នុងនៃមីតូឆុងសៀ។
មេ
បរិមាណ phenylalanine ត្រូវបានប្រើប្រាស់
ក្នុងវិធី ២ យ៉ាង៖
បើក
ក្នុងកំប្រុក
វេន
ក្នុង tyrosine ។
ងាក
phenylalanine ទៅ tyrosine ជាចម្បង
ចាំបាច់ដើម្បីយកលើស
phenylalanine, ចាប់តាំងពីការប្រមូលផ្តុំខ្ពស់
វាពុលដល់កោសិកា។ ការអប់រំ
tyrosine ពិតជាមិនសំខាន់ទេ
ចាប់តាំងពីការខ្វះអាស៊ីដអាមីណូនេះ
នៅក្នុងកោសិកាជាក់ស្តែងមិនកើតឡើងទេ។
មេ
ការរំលាយអាហារ phenylalanine ចាប់ផ្តើម
ជាមួយអ៊ីដ្រូសែនរបស់វា (រូបភាព ៩-២៩)
ជាលទ្ធផលនៅក្នុងការ tyrosine ។
ប្រតិកម្មនេះត្រូវបានបង្កើតឡើងដោយកត្តាជាក់លាក់
monooxy-nase - phenylalanine hydra (zsilase,
ដែលដើរតួជាសហអ្នកផលិត
tetrahydrobiopterin (N4BP) ។
សកម្មភាពអង់ស៊ីមក៏អាស្រ័យលើដែរ
វត្តមានរបស់ Fe2 ។
នៅ
ថ្លើមត្រូវបានបង្កើនការប្រមូលផ្តុំជាចម្បង
glycogen (សូមមើលផ្នែកទី ៧) ។ ទោះយ៉ាងណាស្តុក
គ្លីកូហ្សែននៅក្នុងថ្លើមត្រូវបានរលាយអស់
18-24 ម៉ោងនៃការតមអាហារ។ ប្រភពសំខាន់
គ្លុយកូសនៅពេលស្តុកអស់
គ្លីកូហ្សែនក្លាយជា gluconeogenesis,
ដែលចាប់ផ្តើមពន្លឿន
រូបភព។
១១-២៩ ។ ការផ្លាស់ប្តូរមេតាប៉ូលីសសំខាន់ៗ
ថាមពលនៅពេលផ្លាស់ប្តូរស្រូបយក
រដ្ឋ postabsorbent ។ ស៊ីធី
- សាកសព ketone, FA - អាស៊ីតខ្លាញ់។
៤-៦ ហ
បន្ទាប់ពីអាហារចុងក្រោយ។ ស្រទាប់ខាងក្រោម
គ្លីសេរីនត្រូវបានប្រើសម្រាប់ការសំយោគគ្លុយកូស។
អាស៊ីតអាមីណូនិង lactate ។ នៅខ្ពស់
អត្រាសំយោគកំហាប់ហ្គូហ្គោល
អាស៊ីតខ្លាញ់កាត់បន្ថយដោយសារតែ
phosphorylation និងអសកម្ម
carboxylase អាសេទីលកូកានិងអត្រា
p-កត់សុីកើនឡើង។ ទោះយ៉ាងណាក៏ដោយ
បង្កើនការផ្គត់ផ្គង់ខ្លាញ់ដល់ថ្លើម
អាស៊ីតដែលត្រូវបានដឹកជញ្ជូន
ពីឃ្លាំងខ្លាញ់។ អាសុីលីកូកូបង្កើតឡើង
នៅក្នុងការកត់សុីនៃអាស៊ីតខ្លាញ់វាត្រូវបានគេប្រើ
នៅក្នុងថ្លើមសម្រាប់ការសំយោគនៃសាកសព ketone ។
នៅ
ជាលិកា adipose ជាមួយនឹងការផ្តោតអារម្មណ៍កើនឡើង
គ្លីកហ្គនកាត់បន្ថយអត្រាសំយោគ
TAG និង lipolysis ត្រូវបានរំញោច។ រំញោច
lipolysis - លទ្ធផលនៃការធ្វើឱ្យសកម្ម
TAG lipase ងាយនឹងអរម៉ូន
adipocytes ស្ថិតនៅក្រោមឥទ្ធិពលនៃគ្លីកហ្គ័រ។
អាស៊ីតខ្លាញ់ក្លាយជារឿងសំខាន់
ប្រភពថាមពលនៅក្នុងថ្លើមសាច់ដុំនិង
ជាលិកា adipose ។
ដូច្នេះ
ដូច្នេះនៅក្នុងរយៈពេលក្រោយការរំលោះ
កំហាប់គ្លុយកូសក្នុងឈាមត្រូវបានរក្សា
នៅកំរិត ៨០-១០០ មីលីក្រាម / dl និងកំរិតខ្លាញ់
អាស៊ីតនិងរាងកាយ ketone កើនឡើង។
ស្ករ
ជំងឺទឹកនោមផ្អែមគឺជាជំងឺមួយដែលកើតឡើង
ដោយសារតែដាច់ខាតឬសាច់ញាតិ
កង្វះអាំងស៊ុយលីន។
ក។
ទំរង់គ្លីនិកសំខាន់ៗនៃជាតិស្ករ
ទឹកនោមផ្អែម
នេះបើយោងតាម
អង្គការពិភពលោក
ជំងឺទឹកនោមផ្អែមថែទាំសុខភាព
ចាត់ថ្នាក់តាមភាពខុសគ្នា
កត្តាហ្សែននិងគ្លីនិក
ទំរង់សំខាន់ពីរគឺជម្ងឺទឹកនោមផ្អែម
ប្រភេទ I - អាំងស៊ុយលីនពឹងផ្អែក (IDDM) និងទឹកនោមផ្អែម
ប្រភេទទី ២ - ឯករាជ្យមិនមែនអាំងស៊ុយលីន (អិនឌីឌីអេម) ។
បទប្បញ្ញត្តិ
សំយោគនៃ zhk អង់ស៊ីមបទប្បញ្ញត្តិ
សំយោគនៃ lcd - អាសេទីលកូកាកាឡាក់ស៊ី។
អង់ស៊ីមនេះត្រូវបានគ្រប់គ្រងដោយមនុស្សជាច្រើន
វិធី។
ការធ្វើឱ្យសកម្ម / ការបែកបាក់
ភាពស្មុគស្មាញនៃអនុអង់ហ្ស៊ីម។ នៅ
សំណុំបែបបទអសកម្មនៃអាសេអ៊ីលកូកាអ៊ីមកាបូអ៊ីល
តំណាងឱ្យស្មុគស្មាញដាច់ដោយឡែក
ពួកវានីមួយៗមាន ៤ អនុ។
សកម្មភាពរបស់អង់ស៊ីមគឺ citrate ។ វារំញោច
ជាលទ្ធផលនៃការរួមបញ្ចូលគ្នានៃស្មុគស្មាញ
សកម្មភាពរបស់អង់ស៊ីមកើនឡើង
។ Inhibitor-palmitoyl-CoA ។ គាត់ហៅ
ការបែកបាក់ស្មុគស្មាញនិងថយចុះ
សកម្មភាពអង់ស៊ីម។
Phosphorylation / Dephosphorylation
carboxylase acetyl CoA ។ នៅ
រដ្ឋ postabsorption ឬនៅក្នុង
ការងាររាងកាយមានជាតិស្ករ
adrenaline តាមរយៈ adenylate cyclase
ប្រព័ន្ធនេះត្រូវបានធ្វើឱ្យសកម្មដោយ prokinase A និង
ជំរុញ phosphorylation subunit
carboxylase acetyl CoA ។ ផូស្វ័រ
អង់ស៊ីមគឺអសកម្មនិងសំយោគខ្លាញ់
អាស៊ីតឈប់។
ការស្រូបយក
អាំងស៊ុយលីនរយៈពេលធ្វើឱ្យ phosphatase ដំណើរការ
និង carboxylase អាសេទីល - កូអាចូលទៅក្នុង
dephosphorylated រដ្ឋ។ បន្ទាប់មក
នៅក្រោមឥទ្ធិពលនៃ citrate កើតឡើង
polymerization នៃ protomers នៃអង់ស៊ីមនិង
គាត់ក្លាយជាសកម្ម។ បន្ថែមលើការធ្វើឱ្យសកម្ម
អង់ស៊ីម, citrate អនុវត្តមួយផ្សេងទៀត
មុខងារក្នុងការសំយោគ LCD ។ ការស្រូបយក
កំឡុងពេល mitochondria នៃកោសិកាថ្លើម
កកកុញ citrate ដែលក្នុងនោះ
សំណល់អារីសត្រូវបានបញ្ជូនទៅ
cytosol ។
បទប្បញ្ញត្តិ
អត្រាអុកស៊ីតកម្ម។
ផ្លូវអុកស៊ីតកម្ម - ការរំលាយអាហារ
ភ្ជាប់យ៉ាងរឹងមាំទៅនឹងការងាររបស់ CPE និងទូទៅ
វិធីនៃ catabolism ។ ដូច្នេះល្បឿនរបស់វា
កំណត់ដោយតម្រូវការកោសិកាសម្រាប់
ថាមពល i.e. ដោយអនុបាតនៃ ATP / ADP និង NADH / NAD ក៏ដូចជាអត្រាប្រតិកម្មនៃ CPE និង
ផ្លូវធម្មតានៃ catabolism ។ ល្បឿន
អុកស៊ីតកម្មβនៅក្នុងជាលិកាអាស្រ័យលើភាពអាចរកបាន
ស្រទាប់ខាងក្រោមឧ។
លើបរិមាណខ្លាញ់
អាសុីតចូលក្នុងមីតូសូដូរី។
ការប្រមូលផ្តុំអាស៊ីដខ្លាញ់ដោយឥតគិតថ្លៃ
ក្នុងឈាមឡើងនៅពេលធ្វើឱ្យសកម្ម
lipolysis នៅក្នុងជាលិកា adipose ក្នុងអំឡុងពេលតមអាហារ
នៅក្រោមឥទិ្ធពលនៃគ្លូហ្គូហ្គននិងអំឡុងពេលរាងកាយ
ធ្វើការក្រោមឥទិ្ធពលរបស់ adrenaline ។ នៅក្នុងទាំងនេះ
អាស៊ីតខ្លាញ់ក្លាយជា
ប្រភពថាមពលលេចធ្លោ
សម្រាប់សាច់ដុំនិងថ្លើមដែលជាលទ្ធផលនៃការ
អុកស៊ីតកម្ម are ត្រូវបានបង្កើតឡើងដោយអេដអេដអេនិងអាសេទីល - កូអាអ៊ីដ
pyruvate dehydrogenase ស្មុគស្មាញ។
ការផ្លាស់ប្តូរទម្រង់ pyruvate
ពីគ្លុយកូសទៅអាសេអ៊ីល - កូកាថយចុះ។
ការរំលាយអាហារកម្រិតមធ្យមប្រមូលផ្តុំ
glycolysis និងជាពិសេសគ្លុយកូស -៦-ផូស្វាត។
គ្លុយកូស -6-ផូស្វូសរារាំង hexokinase
ហើយដូច្នេះលើកទឹកចិត្ត
ការប្រើប្រាស់គ្លុយកូសក្នុងដំណើរការ
glycolysis ។ ដូច្នេះភាពលេចធ្លោ
ការប្រើប្រាស់ lcd ជាប្រភពសំខាន់
ថាមពលនៅក្នុងជាលិកាសាច់ដុំនិងថ្លើម
រក្សាទុកជាតិគ្លុយកូសសម្រាប់ជាលិកាសរសៃប្រសាទនិង
កោសិកាឈាមក្រហម។
អត្រា ox- កត់សុីផងដែរ
អាស្រ័យលើសកម្មភាពអង់ស៊ីម
carnitine acyltransferases ខ្ញុំ។
នៅក្នុងថ្លើមអង់ស៊ីមនេះត្រូវបានរារាំង។
malonyl CoA ដែលជាសារធាតុបង្កើតឡើង
ជាមួយជីវរូបវិទ្យានៃអិលឌី។ នៅក្នុងរយៈពេលស្រូបយក
glycolysis ត្រូវបានធ្វើឱ្យសកម្មនៅក្នុងថ្លើមនិង
ការបង្កើតអាសេអ៊ីល - កូកាកើនឡើង
ពី pyruvate ។ ប្រតិកម្មសំយោគដំបូង
ការបំលែងអិលអេឌីលី - កូអាទៅជាម៉ាណូលី - កូ។
Malonyl-CoA រារាំងការកត់សុី cd នៃឌី។
ដែលអាចត្រូវបានប្រើសម្រាប់ការសំយោគ
ខ្លាញ់។
ការអប់រំ
malonyl-CoA ពីអាសេទីល - កូអា - បទប្បញ្ញត្តិ
ប្រតិកម្មនៅក្នុងជីវគីមី lcd ។ ប្រតិកម្មដំបូង
ការបំលែងសំយោគ lcd នៃអាសេទីលកូកូទៅ
malonyl CoA ។ អង់ស៊ីមកាតាលីករ
ប្រតិកម្មនេះ (អាសេអ៊ីលកូកាកាឡៃស៊ីល)
ជាកម្មសិទ្ធិរបស់ថ្នាក់នៃសរសៃចង។ គាត់មាន
ជីវឧស្ម័នត្រូវបានចង។ ដំបូង
ដំណាក់កាលប្រតិកម្ម covalent co2
ភ្ជាប់ជាមួយជីវឧស្ម័នដោយសារថាមពល
ATP, នៅក្នុងដំណាក់កាលទី ២ COO- ផ្ទេរ
នៅលើអាសេទីល - កូអាដើម្បីបង្កើតជម្ងឺមូស្គូកូ។
សកម្មភាពអង់ស៊ីមអាកាឡៃខារ៉ូលីឡាអាសេអ៊ី
កំណត់ល្បឿននៃការបន្តបន្ទាប់ទាំងអស់
ប្រតិកម្មសំយោគ lc
citrate ធ្វើឱ្យអង់ស៊ីមសកម្មនៅក្នុងស៊ីតូកូល
carboxylase acetyl CoA ។ Malonyl CoA នៅ
នៅក្នុងវេនរារាំងការផ្ទេរប្រាក់ខ្ពស់ជាងនេះ
អាស៊ីតខ្លាញ់ពីស៊ីតូកូលរហូតដល់ម៉ាទ្រីស
mitochondria រារាំងសកម្មភាព
អាសេទីលពីខាងក្រៅ CoA: carnitine acyltransferase,
ដូច្នេះបិទការកត់សុីនៃខ្ពស់ជាងនេះ
អាស៊ីតខ្លាញ់។
អាសេលី - កូអាអុកឡាកាខេត ate
HS-CoA Citrate

HSCOA ATP Citrate → Acetyl-CoA ADP Pi Oxaloacetate
អាសុីលីកូកូ
នៅក្នុងស៊ីត្រូផ្លាសដើរតួជាស្រទាប់ខាងក្រោមចាប់ផ្តើម
សម្រាប់ការសំយោគ lcd និង oxaloacetate ក្នុង
ស៊ីតូកូលឆ្លងកាត់ការផ្លាស់ប្តូរនៅក្នុង
លទ្ធផលនៃការដែល pyruvate ត្រូវបានបង្កើតឡើង។
ជីវគីមីជីវគីមីកូឡេស្តេរ៉ុល
ការធ្វើកោសល្យវិច័យជីវសាស្ត្រកូឡេស្តេរ៉ុលកើតឡើងនៅក្នុងកម្មវិធី reticulum endoplasmic ។ ប្រភពនៃអាតូមកាបូនទាំងអស់នៅក្នុងម៉ូលេគុលគឺអាសេទីល - ស្កូអេដែលមកពីទីនេះពីមីតូទីនៀនៅស៊ីលីតដូចជាក្នុងការសំយោគអាស៊ីតខ្លាញ់។ ជីវគីមីកូឡេស្តេរ៉ុលស៊ីលេគុលម៉ូលេគុល ATP ចំនួន ១៨ និងម៉ូលេគុល NADPH ១៣ ។
ការបង្កើតកូលេស្តេរ៉ុលកើតឡើងក្នុងប្រតិកម្មជាង ៣០ ដែលអាចត្រូវបានដាក់ជាក្រុមតាមដំណាក់កាលជាច្រើន។
ការសំយោគអាស៊ីតមូស្គូលីន។
ប្រតិកម្មសំយោគពីរដំបូងកើតឡើងស្របគ្នានឹងប្រតិកម្មរបស់ ketogenesis ប៉ុន្តែបន្ទាប់ពីការសំយោគ ៣-hydroxy-3-methylglutaryl-ScoA អង់ស៊ីមចូល hydroxymethyl-glutaryl-ScoA reductase (HMG-SCOA reductase), បង្កើតជាអាស៊ីតម៉ាវ៉ាល់ណូល។
 |